O futuro da terapia génica
Farmazian doktorea. Biofarmazia, Farmakozinetika eta Farmazia-teknologiako irakasle kolaboratzailea
Farmazia Fakultatea UPV-EHU, Vitoria-Gasteiz
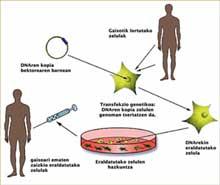
O concepto de terapia génica é relativamente sinxelo e sinxelo: una copia adecuada dun xene entrégase a un paciente paira corrixir o seu trastorno patolóxico, é dicir, o ADN actúa como medicamento na terapia génica. Con todo, levar a cabo con éxito este concepto non é nada fácil. É moi difícil inserir una copia adecuada dun xene nun lugar concreto dunha célula.
A corrección e transferencia de copias de ADN a células apropiadas realízase en moitos casos con virus. Paira moitos virus esta é a vía de provocar una infección: incorporan ao ADN celular da vítima a súa información xenética paira poder reproducirse. Na terapia génica, os investigadores quixeron aproveitar esta capacidade intrínseca de certos virus, pero neste caso paira introducir un xene curativo no ADN da ‘vítima’.
A principios da década dos 90, debido aos prometedores ensaios en animais de laboratorio, varios grupos de investigación de París, Londres e Milán comezaron a realizar ensaios de terapia génica con humanos. O obxectivo era curar o mal dos nenos coñecidos como nenos de burbullas. Estes nenos deben vivir completamente illados do medio, xa que debido a unha inmunodeficiencia, as células que interveñen na resposta inmunológica do corpo non se desenvolven adecuadamente. En consecuencia, calquera enfermidade común pode causar a morte.
Desgraciadamente non hai medicamentos paira curar esta grave enfermidade. O único tratamento sería o transplante de medula ósea de doantes coas mesmas características xenéticas. Con todo, a taxa de eficacia desta última solución é escasa (30%) e presenta un risco de alteracións inmunológicas severas.
XX. Nos ensaios clínicos realizados a finais do século XX participaron un total de 18 nenos. Os ensaios de terapia génica realizáronse con retrovirus, algúns deles que integran a súa información xenética no ADN da vítima. Os resultados foron moi satisfactorios desde o principio. 17 nenos recuperaron a función do sistema inmunológico e hoxe en día están vivos e sans.
Como resultado destes resultados, ademais de verificar o potencial terapéutico da terapia génica, puxéronse en marcha novos ensaios clínicos e impulsouse a creación de industrias biotecnológicas.
Lamentablemente, os dous nenos que participaron no ensaio francés desenvolveron a finais de 2002 una enfermidade similar á leucemia e, de súpeto, o optimismo xerado ao redor desta tecnoloxía converteuse en preocupación e nerviosismo. De feito, moitos lembraban a morte dun mozo noutro ensaio en 1999.
Durante este período, a sobredose de partículas víricas e a resposta inmunológica posterior violenta foron os responsables do resultado tráxico. A aparición de leucemia era una noticia moi grave, por unha banda, porque en todas as investigacións realizadas até entón con animais de laboratorio nunca se tivo coñecemento dunha alteración deste tipo e, doutra banda, volvíase a cuestionar a seguridade da terapia génica.
As consecuencias a curto prazo foron moi duras paira o futuro da terapia génica. Hai que ter en conta que garantir a seguridade dos pacientes é o primeiro requisito que debe cumprir calquera novo tratamento. As asociacións reguladoras da sanidade de varios países prohibiron inmediatamente máis ensaios clínicos e algunhas empresas de terapia génica abandonaron os retrovirus e comezaron a traballar con outros virus que ofrecían maior seguridade.
Éxitos e fracasos da terapia génica
Non cabe dúbida de que a terapia génica é eficaz paira o tratamento das enfermidades que provocan a inmunodeficiencia. As células obtidas da medula ósea dos pacientes son tomadas e transformadas con virus que teñen incorporadas as copias adecuadas do ADN. Una vez que as copias do ADN integráronse nos xenomas das células, obtéñense células maduras e funcionais que se inxectan aos pacientes paira curalas. A aparición da leucemia indicaba que algo había ido mal nese proceso, pero que?
A resposta atopouna o equipo de investigación de Von Kalle, un proceso coñecido como “vacinación mutagénica”. Neste proceso, ao integrarse no xenoma das células, o retrovirus cambiou uns xenes indesexables, entre eles o xene LMO2 que participa nos cancros infantís. Isto puxo de manifesto que o fenómeno a controlar é o lugar exacto no que os virus se integran nos xenomas das células paira evitar que no futuro repítanse estas alteracións. Pero, como se pode conseguir tanta precisión se ao paciente fornécenselle millóns de células curadas no laboratorio?
Buscando solucións
Todos os expertos consideran que o futuro da terapia génica debe basearse na seguridade e a eficacia. Paira logralo, necesítanse vectores de maior seguridade que permitan integrar a copia do ADN unicamente nas células desexadas, con seguridade, eficacia e precisión.
Hai quen opina que os transportadores que non se incorporan ao xenoma poden ser una boa opción, pero outros creen que os únicos virus que son útiles paira producir cambios a longo prazo nas células son os retrovirus. De face á seguridade tamén se poden utilizar virus que levan ‘xenes suicidas’. Estes virus, se se integran en células inadecuadas ou se multiplican incontroladamente, poden inactivarse despois de administrar un fármaco ao paciente.
Doutra banda, nos últimos anos optimizáronse os chamados sistemas de expresión génica de primeira xeración. Nestes sistemas, os transportadores responden a estímulos concretos: medicamentos, calor, radiación, cantidade de glicosa ou osíxeno, etc.
Por exemplo, o sistema de expresión génica integrado nun paciente con diabetes terá como obxectivo producir insulina, pero esta produción debe estar moi controlada paira evitar hiperglucemias e hipoglucemias. Con estes novos sistemas pódese deseñar un sistema que produza máis ou menos insulina en función do nivel de glicosa, de forma que a insulina só se solte cando o necesita o paciente e ademais á dose necesaria.
Tamén se está investigando un sistema similar de tratamento da anemia, que produce eritropoyetina (EPO) en función do nivel de osíxeno no sangue.
Xunto a iso, é imprescindible mellorar os controis de calidade dispoñibles paira o estudo das células transformadas con ADN. O desenvolvemento de técnicas moleculares e xenéticas adecuadas permitiría analizar mostras de feixes celulares modificados en cada quenda. O mellor sería estudar todas as células, porque cada una ten as súas propias características, pero hoxe en día parece imposible, xa que se tarda moito tempo e os ensaios nunca finalizarían.
A recuperación da confianza perdida tardará en recuperarse, pero co tempo, os pacientes de terapia génica produciron sistemas máis eficientes e, sobre todo, máis seguros. Aínda que queda moito traballo por facer, pódese afirmar que a terapia génica aínda non escribiu o seu último capítulo.
BIBLIOGRAFÍA
- Orive, G. e outra ‘Terapia génica, da
esperanza á
realidade’ Elhuyar Zientzia eta Teknika, 170:27-32 (2001).
Cavazzana-Calvo, M. e outros ‘Gene
therapy of human severe combined inmunodeficiency (SCID)-X1 disease’
Science, 288:669-672 (2000).
Check, E.
‘Second cancer case halts gene-therapy trials’
Nature, 421:305 (2003).