L'avenir de la thérapie génique
Farmazian doktorea. Biofarmazia, Farmakozinetika eta Farmazia-teknologiako irakasle kolaboratzailea
Farmazia Fakultatea UPV-EHU, Vitoria-Gasteiz
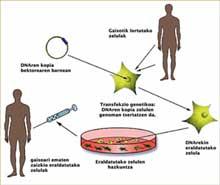
Le concept de thérapie génique est relativement simple et simple : une copie adéquate d'un gène est remise à un patient pour corriger son trouble pathologique, c'est-à-dire que l'ADN agit comme médicament dans la thérapie génique. Cependant, la réussite de ce concept n'est pas facile. Il est très difficile d'insérer une copie appropriée d'un gène dans un endroit particulier d'une cellule.
La correction et le transfert de copies d'ADN vers des cellules appropriées sont souvent effectuées avec des virus. Pour de nombreux virus, c'est le moyen de provoquer une infection : ils incorporent à l'ADN cellulaire de la victime leur information génétique pour pouvoir se reproduire. Dans la thérapie génique, les chercheurs ont voulu exploiter cette capacité intrinsèque de certains virus, mais dans ce cas pour introduire un gène curatif dans l’ADN de la «victime».
Au début des années 90, en raison des essais prometteurs sur les animaux de laboratoire, plusieurs groupes de recherche de Paris, Londres et Milan ont commencé à effectuer des essais de thérapie génique avec des humains. Le but était de guérir le mal des enfants connus comme des enfants à bulles. Ces enfants doivent vivre complètement isolés du milieu, car en raison d'une immunodéficience, les cellules qui interviennent dans la réponse immunitaire du corps ne se développent pas correctement. Par conséquent, toute maladie commune peut causer la mort.
Malheureusement, il n'y a pas de médicaments pour guérir cette maladie grave. Le seul traitement serait la greffe de moelle osseuse des donneurs ayant les mêmes caractéristiques génétiques. Cependant, le taux d'efficacité de cette dernière solution est faible (30%) et présente un risque de troubles immunologiques sévères.
XX. Au total, 18 enfants ont participé aux essais cliniques réalisés à la fin du XXe siècle. Les essais de thérapie génique ont été effectués avec des retrovirus, certains d'entre eux qui intègrent leur information génétique dans l'ADN de la victime. Les résultats ont été très satisfaisants dès le début. 17 enfants ont retrouvé la fonction du système immunitaire et sont aujourd'hui en vie et en bonne santé.
À la suite de ces résultats, en plus de vérifier le potentiel thérapeutique de la thérapie génique, de nouveaux essais cliniques ont été lancés et la création d'industries biotechnologiques a été encouragée.
Malheureusement, les deux enfants qui ont participé à l'essai français ont développé fin 2002 une maladie similaire à la leucémie et, soudain, l'optimisme généré autour de cette technologie est devenu inquiétude et nervosité. En fait, beaucoup se souvenaient de la mort d'un jeune dans un autre essai en 1999.
Pendant cette période, le surdosage de particules virales et la réponse immunologique ultérieure violente ont été responsables du résultat tragique. L'apparition de leucémie était une nouvelle très grave, d'une part, parce que dans toutes les recherches effectuées jusque-là avec des animaux de laboratoire, on n'avait jamais eu connaissance d'une telle altération et, d'autre part, on remettait en question la sécurité de la thérapie génique.
Les conséquences à court terme ont été très dures pour l'avenir de la thérapie génique. Gardez à l'esprit que garantir la sécurité des patients est la première exigence qui doit répondre à tout nouveau traitement. Les associations de régulation de la santé de plusieurs pays ont immédiatement interdit d'autres essais cliniques et certaines entreprises de thérapie génique ont abandonné les rétrovirus et ont commencé à travailler avec d'autres virus offrant une plus grande sécurité.
Succès et échecs de la thérapie génique
Il ne fait aucun doute que la thérapie génique est efficace pour le traitement des maladies qui provoquent l'immunodéficience. Les cellules obtenues de la moelle osseuse des patients sont prises et transformées par des virus qui ont incorporé les copies appropriées de l'ADN. Une fois que les copies de l'ADN ont été intégrées dans les génomes des cellules, des cellules matures et fonctionnelles sont obtenues qui sont injectées aux patients pour les guérir. L'apparition de la leucémie indiquait que quelque chose s'était mal passé dans ce processus, mais quoi ?
La réponse a été trouvée par l’équipe de recherche de von Kalle, un processus connu sous le nom de « vaccination mutagène ». Dans ce processus, en s'intégrant dans le génome des cellules, le retrovirus a changé quelques gènes indésirables, dont le gène LMO2 qui participe aux cancers d'enfant. Cela a montré que le phénomène à contrôler est l'endroit exact où les virus sont intégrés dans les génomes des cellules pour empêcher à l'avenir de répéter ces modifications. Mais comment peut-on obtenir une telle précision si le patient reçoit des millions de cellules guéries en laboratoire?
Recherche de solutions
Tous les experts considèrent que l'avenir de la thérapie génique doit être fondée sur la sécurité et l'efficacité. Pour ce faire, des vecteurs de plus grande sécurité sont nécessaires pour intégrer l'ADN uniquement dans les cellules souhaitées, avec sécurité, efficacité et précision.
Certains pensent que les transporteurs qui ne sont pas incorporés au génome peuvent être une bonne option, mais d'autres pensent que les seuls virus qui sont utiles pour produire des changements à long terme dans les cellules sont les retrovirus. En ce qui concerne la sécurité, on peut aussi utiliser des virus portant des gènes suicidaires. Ces virus, s'ils sont intégrés dans des cellules inadéquates ou multipliés de manière incontrôlée, peuvent être inactivés après avoir administré un médicament au patient.
D'autre part, ces dernières années, les systèmes d'expression génique dits de première génération ont été optimisés. Dans ces systèmes, les transporteurs répondent à des stimuli spécifiques : médicaments, chaleur, rayonnement, quantité de glucose ou oxygène, etc.
Par exemple, le système d'expression génique intégré dans un patient diabétique vise à produire de l'insuline, mais cette production doit être très contrôlée pour éviter les hyperglycémies et les hypoglycémies. Avec ces nouveaux systèmes, vous pouvez concevoir un système qui produit plus ou moins d'insuline en fonction du niveau de glucose, de sorte que l'insuline ne se relâche que lorsque le patient en a besoin et aussi à la dose nécessaire.
Un système similaire de traitement de l'anémie, qui produit de l'érythropoïétine (EPO) est également en cours de recherche en fonction du niveau d'oxygène dans le sang.
Parallèlement, il est indispensable d'améliorer les contrôles de qualité disponibles pour l'étude des cellules transformées en ADN. Le développement de techniques moléculaires et génétiques appropriées permettrait d'analyser des échantillons de faisceaux cellulaires modifiés à chaque tour. Il serait préférable d'étudier toutes les cellules, parce que chacune a ses propres caractéristiques, mais aujourd'hui il semble impossible, car il faut beaucoup de temps et les essais ne finiraient jamais.
Le rétablissement de la confiance perdue prendra fin, mais avec le temps, les patients de thérapie génique ont produit des systèmes plus efficaces et, surtout, plus sûrs. Bien qu'il reste beaucoup de travail à faire, on peut affirmer que la thérapie génique n'a pas encore écrit son dernier chapitre.
BIBLIOGRAPHIE
- Orive, G. et autres ‘Thérapie génique, de l'espoir
à la
réalité’ Elhuyar Zientzia eta Teknika, 170:27-32 (2001).
Cavazzana-Calvo, M. et autres ‘Gene
therapy of human severe combined immunodéficiency (SCID)-X1 disease’
Science, 288:669-672 (2000).
Check, E.
‘Second cancer case halts gene-therapy trials’
Nature, 421:305 (2003).