El futur de la teràpia gènica
Farmazian doktorea. Biofarmazia, Farmakozinetika eta Farmazia-teknologiako irakasle kolaboratzailea
Farmazia Fakultatea UPV-EHU, Vitoria-Gasteiz
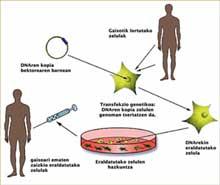
El concepte de teràpia gènica és relativament senzill i senzill: una còpia adequada d'un gen es lliura a un pacient per a corregir el seu trastorn patològic, és a dir, l'ADN actua com a medicament en la teràpia gènica. No obstant això, dur a terme amb èxit aquest concepte no és gens fàcil. És molt difícil inserir una còpia adequada d'un gen en un lloc concret d'una cèl·lula.
La correcció i transferència de còpies d'ADN a cèl·lules apropiades es realitza en molts casos amb virus. Per a molts virus aquesta és la via de provocar una infecció: incorporen a l'ADN cel·lular de la víctima la seva informació genètica per a poder reproduir-se. En la teràpia gènica, els investigadors han volgut aprofitar aquesta capacitat intrínseca de certs virus, però en aquest cas per a introduir un gen curatiu en l'ADN de la ‘víctima’.
A principis de la dècada dels 90, a causa dels prometedors assajos en animals de laboratori, diversos grups de recerca de París, Londres i Milà van començar a realitzar assajos de teràpia gènica amb humans. L'objectiu era curar el mal dels nens coneguts com a nens de bombolles. Aquests nens han de viure completament aïllats del mitjà, ja que a causa d'una immunodeficiència, les cèl·lules que intervenen en la resposta immunològica del cos no es desenvolupen adequadament. En conseqüència, qualsevol malaltia comuna pot causar la mort.
Desgraciadament no hi ha medicaments per a curar aquesta greu malaltia. L'únic tractament seria el trasplantament de medul·la òssia de donants amb les mateixes característiques genètiques. No obstant això, la taxa d'eficàcia d'aquesta última solució és escassa (30%) i presenta un risc d'alteracions immunològiques severes.
XX. En els assajos clínics realitzats a la fi del segle XX van participar un total de 18 nens. Els assajos de teràpia gènica es van realitzar amb retrovirus, alguns d'ells que integren la seva informació genètica en l'ADN de la víctima. Els resultats van ser molt satisfactoris des del principi. 17 nens van recuperar la funció del sistema immunològic i avui dia estan vius i sans.
Com a resultat d'aquests resultats, a més de verificar el potencial terapèutic de la teràpia gènica, es van posar en marxa nous assajos clínics i es va impulsar la creació d'indústries biotecnològiques.
Lamentablement, els dos nens que van participar en l'assaig francès van desenvolupar a la fi de 2002 una malaltia similar a la leucèmia i, de sobte, l'optimisme generat entorn d'aquesta tecnologia es va convertir en preocupació i nerviosisme. De fet, molts recordaven la mort d'un jove en un altre assaig en 1999.
Durant aquest període, la sobredosi de partícules víriques i la resposta immunològica posterior violenta van ser els responsables del resultat tràgic. L'aparició de leucèmia era una notícia molt greu, d'una banda, perquè en totes les recerques realitzades fins llavors amb animals de laboratori mai s'havia tingut coneixement d'una alteració d'aquest tipus i, d'altra banda, es tornava a qüestionar la seguretat de la teràpia gènica.
Les conseqüències a curt termini van ser molt dures per al futur de la teràpia gènica. Cal tenir en compte que garantir la seguretat dels pacients és el primer requisit que ha de complir qualsevol nou tractament. Les associacions reguladores de la sanitat de diversos països van prohibir immediatament més assajos clínics i algunes empreses de teràpia gènica van abandonar els retrovirus i van començar a treballar amb altres virus que oferien major seguretat.
Èxits i fracassos de la teràpia gènica
No hi ha dubte que la teràpia gènica és eficaç per al tractament de les malalties que provoquen la immunodeficiència. Les cèl·lules obtingudes de les medul·la òssia dels pacients són preses i transformades amb virus que tenen incorporades les còpies adequades de l'ADN. Una vegada que les còpies de l'ADN s'han integrat en els genomes de les cèl·lules, s'obtenen cèl·lules madures i funcionals que s'injecten als pacients per a curar-les. L'aparició de la leucèmia indicava que alguna cosa havia anat malament en aquest procés, però què?
La resposta la va trobar l'equip de recerca de Von Kalle, un procés conegut com a “vacunació mutagènica”. En aquest procés, en integrar-se en el genoma de les cèl·lules, el retrovirus va canviar uns gens indesitjables, entre ells el gen LMO2 que participa en els càncers infantils. Això va posar de manifest que el fenomen a controlar és el lloc exacte en el qual els virus s'integren en els genomes de les cèl·lules per a evitar que en el futur es repeteixin aquestes alteracions. Però, com es pot aconseguir tanta precisió si al pacient se li subministren milions de cèl·lules curades en el laboratori?
Buscant solucions
Tots els experts consideren que el futur de la teràpia gènica ha de basar-se en la seguretat i l'eficàcia. Per a aconseguir-ho, es necessiten vectors de major seguretat que permetin integrar la còpia de l'ADN únicament en les cèl·lules desitjades, amb seguretat, eficàcia i precisió.
Hi ha qui opina que els transportadors que no s'incorporen al genoma poden ser una bona opció, però uns altres creuen que els únics virus que són útils per a produir canvis a llarg termini en les cèl·lules són els retrovirus. De cara a la seguretat també es poden utilitzar virus que porten ‘gens suïcides’. Aquests virus, si s'integren en cèl·lules inadequades o es multipliquen incontroladament, poden inactivar-se després d'administrar un fàrmac al pacient.
D'altra banda, en els últims anys s'han optimitzat els anomenats sistemes d'expressió gènica de primera generació. En aquests sistemes, els transportadors responen a estímuls concrets: medicaments, calor, radiació, quantitat de glucosa o oxigen, etc.
Per exemple, el sistema d'expressió gènica integrat en un pacient amb diabetis tindrà com a objectiu produir insulina, però aquesta producció ha d'estar molt controlada per a evitar hiperglucemias i hipoglucèmies. Amb aquests nous sistemes es pot dissenyar un sistema que produeixi més o menys insulina en funció del nivell de glucosa, de manera que la insulina només es deixi anar quan el necessita el pacient i a més a la dosi necessària.
També s'està investigant un sistema similar de tractament de l'anèmia, que produeix eritropoetina (EPO) en funció del nivell d'oxigen en la sang.
Al costat d'això, és imprescindible millorar els controls de qualitat disponibles per a l'estudi de les cèl·lules transformades amb ADN. El desenvolupament de tècniques moleculars i genètiques adequades permetria analitzar mostres de feixos cel·lulars modificats en cada torn. El millor seria estudiar totes les cèl·lules, perquè cadascuna té les seves pròpies característiques, però avui dia sembla impossible, ja que es triga molt temps i els assajos mai finalitzarien.
La recuperació de la confiança perduda trigarà a recuperar-se, però amb el temps, els pacients de teràpia gènica han produït sistemes més eficients i, sobretot, més segurs. Encara que queda molta feina per fer, es pot afirmar que la teràpia gènica encara no ha escrit el seu últim capítol.
BIBLIOGRAFIA
- Orive, G. i altres ‘Teràpia gènica, de l'esperança
a la
realitat’ Elhuyar Zientzia eta Teknika, 170:27-32 (2001).
Cavazzana-Calvo, M. i uns altres ‘Gene
therapy of human severe combined inmunodeficiency (SCID)-X1 disease’
Science, 288:669-672 (2000).
Check, E.
‘Second cancer casi halts gene-therapy trials’
Nature, 421:305 (2003).