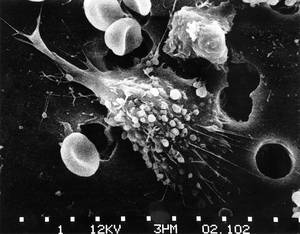
Du laboratoire à la clinique

De la table de travail à la tête du lit (from bench to bedside), on connaît ainsi la recherche dirigée directement à la thérapie, qui est menée dans divers laboratoires qui étudient dans le traitement du cancer dans le monde entier. José Antonio Rodriguez a travaillé dans un de ces laboratoires jusqu'à il y a quatre ans et, à son avis, "c'est un concept très intéressant".
José Antonio Rodríguez est maintenant professeur au département de génétique de l'UPV. Il a passé trois ans plus tôt en Australie et sept autres en Hollande dans la recherche sur le cancer: « En Hollande, j'ai travaillé dans un hôpital, pas à l'université. Il travaillait dans le département d'oncologie médicale et il y a deux lignes: dans l'une d'elles traitent les patients et dans l'autre étudient les mécanismes des médicaments en cellules tumorales qui sont maintenus dans les préparations de croissance. J'ai travaillé sur cette seconde, parce que je suis biologiste, pas médecin, mais les deux lignes sont étroitement liées ».
Selon Rodriguez, cette façon de travailler est appropriée pour les thérapies biologiques. "Dans la chimiothérapie, par exemple, les chercheurs essaient de savoir quelle est la dose maximale qu'ils peuvent donner, puis donner aux patients une dose inférieure. Les thérapies biologiques, quant à elles, sont moins toxiques et il n'y a souvent pas de doses maximales. Leur efficacité doit être prouvée autrement. Il s'agit de mesurer les marqueurs biologiques (par exemple, la concentration d'une protéine) et de voir si le médicament interfère avec la signalisation cellulaire que nous voulons empêcher".
Le blocage de ces sentiers est la base sur laquelle reposent de nombreuses thérapies qui sont testées: l'identification des mécanismes ou des sentiers nécessaires à la croissance, la reproduction et la diffusion des cellules tumorales et leur obstruction par des molécules développées en laboratoire. Comme l'explique Rodriguez, ces sentiers sont également utilisés par des cellules conventionnelles, mais n'utilisent pas une seule, mais quatre ou cinq, pour faire de même. Au contraire, les cellules tumorales ont une suractivation dans l'une d'elles et d'autres ne les utilisent pas parce qu'elles n'en ont pas besoin. "Ce sentier de suractivation apporte un avantage à la cellule mais aussi un point faible en même temps (Talon d'Achille). Si nous bloquons ce sentier qui leur donne l'avantage, la cellule meurt ».
Dans la section de Rodriguez, par exemple, ils enquêtaient sur les inhibiteurs de l'EGFRa. L'EGFR est un récepteur situé sur la surface cellulaire ( epidermal growth factor récepteur ) qui contrôle que le gène qui le contrôle est muté ou que son expression est excessive peut causer le cancer. "Le blocage de la signalisation EGFR empêche le développement du cancer. Car les inhibiteurs testés par nous sont déjà utilisés dans les patients. L'un d'eux est l'erlotinib, utilisé dans les hôpitaux pour traiter les cancers du poumon ». Des molécules anti-COV, l'erlotinib ou d'autres inhibiteurs du cerveau, du côlon et d'autres cancers sont également testées, selon le mécanisme de chaque type de tumeur.
Notez qu'il existe de nombreux types de cancer. « Beaucoup disent que chaque patient a un type de cancer, le sien », dit Rodriguez. Par conséquent, les chercheurs doivent rechercher les inhibiteurs les plus appropriés de tous les cancers. Pour cela, il est nécessaire d'analyser les défauts génétiques (mutations) qui ont causé la tumeur.
La guerre aux résistances
Dans tous les cas, Rodriguez avertit que cette stratégie a une limite: "Le problème est qu'ils développent des résistances aux inhibiteurs".
Avec le temps, lorsque nous inhibons un sentier, les cellules tumorales commencent à utiliser d'autres sentiers qui servent à faire la même chose et deviennent résistants à l'inhibiteur. Ils doivent donc être gérés conjointement.
Selon les mots de Rodriguez, « c'est une guerre, et quand un chemin est fermé, nous devons essayer pour un autre ». Outre la voie des inhibiteurs des voies, il est également important que les anticorps monoclonaux. Comprend, par exemple, un trastuzumab (Herceptine), un anticorps contre un récepteur similaire à l'EGFR. Trastuzumab est habituellement utilisé contre le cancer du sein et est maintenant également testé dans les essais cliniques d'autres types de cancer.

Ces anticorps sont générés dans le laboratoire et sont capables de se joindre spécifiquement à un antigène particulier. Les anticorps monoclonaux ont été utilisés depuis longtemps dans le diagnostic du cancer. En tant que thérapie, les chercheurs tentent d'identifier à la surface des cellules tumorales les antigènes liés à la croissance (par exemple. récepteurs de facteurs de croissance) et de concevoir les anticorps associés à eux. De cette façon, les anticorps sont attachés aux antigènes et les cellules ne peuvent pas se développer.
Des anticorps monoclonaux spécifiquement conçus pour la promotion du système immunitaire sont également utilisés.
Vaccins contre le cancer
En ce qui concerne le système immunitaire, une autre voie en cours de recherche pour combattre le cancer est la vaccination.
Les vaccins utilisés dans les maladies infectieuses sont administrés avant l'apparition de la maladie. Ces vaccins contiennent des fragments d'antigènes de l'agent infectieux ou désactivés par le même agent et visent à préparer le système immunitaire lorsque l'agent pénètre dans le corps. D'une certaine manière, les vaccins lui enseignent qui est l'agresseur, ce qui permet au corps de préparer les meilleures armes contre lui.
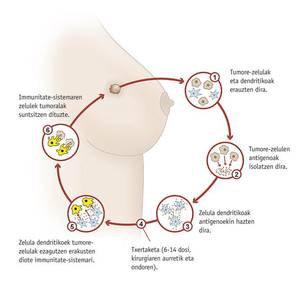
Les vaccins contre le cancer, cependant, seraient utilisés après l'apparition de la maladie pour la traiter ou empêcher sa diffusion. L'un d'eux est testé à la Clinique Université de Navarre. L'objectif du vaccin est d'éviter l'apparition d'un cancer du sein après avoir été traité et des cellules dendritiques de la femme (cellules du système immunitaire) qui sont stimulées par les cellules tumorales du patient. Ainsi, ils enseignent aux cellules dendritiques quel est l'agresseur.
Marta Santisteban, responsable de la recherche, a indiqué qu'elle était testée avec un sous-groupe de patients atteints de cancer du sein et qu'ils sauront s'il est efficace en mai 2012. Dans tous les cas, elle compléterait la thérapie oncologique conventionnelle et non la chirurgie, la radiothérapie et la chimiothérapie.
Outre la lutte contre le cancer du sein, des vaccins sont également testés pour d'autres cancers dans d'autres cultures telles que la prostate, rein, ovaire, côlon...
Cependant, Rodriguez estime que même si les vaccins sont efficaces, il sera difficile pour la molécule de devenir inhibiteur et conventionnel. « La question est qu'ils sont des autologos, c'est-à-dire qu'ils sont faits avec des cellules du patient lui-même. Par conséquent, chacun doit faire de son mieux, et cela n'est pas à la portée de tous, car il est très cher ».
Virus, cheval de Troie
Une autre stratégie qui donne de bons résultats est celle des virus. Rodríguez explique en quoi consiste : "Ils tentent de transformer le génome des virus afin qu'ils puissent détruire les cellules tumorales sans détruire les cellules normales. Les virus oncologiques sont fréquents. Ces virus ont été modifiés gènes afin qu'ils ne puissent entrer dans les cellules tumorales. En entrant dans une cellule tumorale, les virus ne font que les diviser encore et encore jusqu'à ce que la cellule explose ».
À d'autres occasions, un gène est introduit qui codifie un toxique. Ainsi, une fois introduites dans la cellule, elles produisent le toxique et tuent activement la cellule. Armed viruses". Les virus armés.
Les virus oncologiques et armés sont des exemples de thérapie génique et leurs recherches et essais cliniques sont assez avancés. D'autres qui sont testés dans la barre de thérapie génique sont trouvés dans les phases ultérieures. Parmi eux figurent les essais de remplacement des gènes mutés en cellules par des gènes sains. D'autres laboratoires incluent des gènes spécifiques dans les cellules tumorales pour être plus sensibles à la radiothérapie et à la chimiothérapie. Certains cherchent également à introduire des gènes qui empêchent l'angiogenèse, avec lesquels les tumeurs ne peuvent pas produire et répandre des vaisseaux sanguins.
Nombreux sont les chemins que les chercheurs testent. Certains sont encore en phase expérimentale, mais d'autres sont déjà très avancés et ont été autorisés à l'utiliser. De plus en plus d'opportunités ouvrent la voie à l'espérance.