Del laboratorio a la clínica

De la mesa de trabajo a la cabecera de la cama (from bench to bedside), así se conoce a la investigación dirigida directamente a la terapia, que se está llevando a cabo en diversos laboratorios que investigan en el tratamiento del cáncer en todo el mundo. José Antonio Rodriguez trabajó en uno de estos laboratorios hasta hace cuatro años y, en su opinión, "es un concepto muy interesante".
José Antonio Rodríguez es ahora profesor del Departamento de Genética de la UPV. Pasó tres años antes en Australia y otros siete en Holanda en la investigación del cáncer: "En Holanda trabajé en un hospital, no en la universidad. Trabajaba en el departamento de Oncología Médica y allí tienen dos líneas: en una de ellas tratan a los pacientes y en la otra estudian los mecanismos de los medicamentos en células tumorales que se mantienen en los preparados de crecimiento. Yo trabajé en esa segunda, porque soy biólogo, no médico, pero las dos líneas están estrechamente relacionadas".
Según Rodríguez, esta forma de trabajar es apropiada para terapias biológicas. "En la quimioterapia, por ejemplo, los investigadores tratan de saber cuál es la dosis máxima que pueden dar y luego dan a los pacientes una dosis inferior. Las terapias biológicas, por su parte, son menos tóxicas y en ellas muchas veces no hay dosis máximas. Su eficacia debe ser probada de otra manera. Se trata de medir marcadores biológicos (por ejemplo, la concentración de una proteína) y ver si el medicamento interfiere con la señalización celular que queremos impedir".
El bloqueo de estos senderos es la base sobre la que se asientan muchas de las terapias que se están probando: la identificación de los mecanismos o senderos necesarios para el crecimiento, reproducción y difusión de las células tumorales y su obstrucción mediante moléculas desarrolladas en el laboratorio. Según explica Rodríguez, estos senderos también son utilizados por células convencionales, pero no utilizan una sola, sino cuatro o cinco, para hacer lo mismo. Por el contrario, las células tumorales tienen una sobreactivación en una de ellas y otras no las utilizan porque no las necesitan. "Esta senda de sobreactivación aporta ventaja a la célula pero también un punto débil al mismo tiempo ( Talón de Aquiles ). Si bloqueamos este sendero que les da ventaja, la célula muere".
En la sección de Rodríguez, por ejemplo, investigaban a los inhibidores del EGFRa. El EGFR es un receptor situado en la superficie celular ( epidermal growth factor receptor ) que controla que el gen que lo controla esté mutado o que su expresión sea excesiva puede causar cáncer. "El bloqueo de la señalización de EGFR impide el desarrollo del cáncer. Pues los inhibidores probados por nosotros ya se utilizan en los pacientes. Uno de ellos es el erlotinib, utilizado en los hospitales para tratar los cánceres de pulmón". También se están probando moléculas anti-COVs, el propio erlotinib u otros inhibidores en cerebro, colon y otros tipos de cáncer, dependiendo del mecanismo de cada tipo de tumor.
Hay que tener en cuenta que hay muchos tipos de cáncer. "Muchos dicen que cada paciente tiene un tipo de cáncer, el suyo", dice Rodríguez. Por ello, los investigadores deben buscar los inhibidores más adecuados de todos los cánceres. Para ello es necesario analizar los defectos genéticos (mutaciones) que han originado el tumor.
La guerra a las resistencias
En cualquier caso, Rodríguez advierte que esta estrategia tiene un límite: "El problema es que desarrollan resistencias a los inhibidores".
Con el tiempo, cuando inhibimos una senda, las células tumorales empiezan a utilizar otras sendas que sirven para hacer lo mismo y se vuelven resistentes al inhibidor. Por ello, deben administrarse de forma combinada.
En palabras de Rodríguez, "esta es una guerra, y cuando se cierra un camino debemos intentar por otro". Además de la vía de los inhibidores de las sendas, también es importante la de los anticuerpos monoclonales. Incluye, por ejemplo, trastuzumab (Herceptina), anticuerpo contra un receptor similar al EGFR. Trastuzumab se utiliza habitualmente contra el cáncer de mama y ahora también está probando en ensayos clínicos otros tipos de cáncer.

Estos anticuerpos se generan en el laboratorio y son capaces de unirse específicamente a un antígeno concreto. Los anticuerpos monoclonales han sido utilizados desde hace tiempo en el diagnóstico del cáncer. A modo de terapia, los investigadores intentan identificar en la superficie de las células tumorales los antígenos relacionados con el crecimiento (p.ej. receptores de factores de crecimiento) y diseñar los anticuerpos asociados a ellos. De esta forma, los anticuerpos se unen a los antígenos y las células no pueden crecer.
También se utilizan anticuerpos monoclonales diseñados específicamente para el fomento del sistema inmunitario.
Vacunas contra el cáncer
En relación al sistema inmunitario, otra de las vías que se están investigando para combatir el cáncer es la vacunación.
Las vacunas utilizadas en enfermedades infecciosas se administran antes de la aparición de la enfermedad. Estas vacunas contienen fragmentos de antígenos del agente infeccioso o desactivados por el mismo agente y tienen como objetivo preparar el sistema inmunitario cuando el agente entra en el cuerpo. De alguna manera, las vacunas le enseñan quién es el agresor, lo que permite al cuerpo preparar las mejores armas contra él.
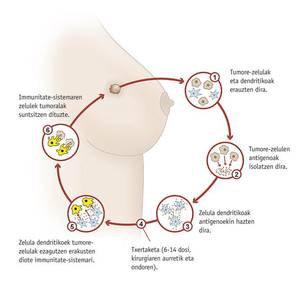
Las vacunas contra el cáncer, sin embargo, se utilizarían después de la aparición de la enfermedad para tratarla o impedir su difusión. Uno de ellos está siendo probado en la Clínica Universidad de Navarra. El objetivo de la vacuna es evitar la aparición de un cáncer de mama después de ser tratado y para ello se utilizan células dendríticas de la mujer (células del sistema inmunitario) que son estimuladas con células tumorales del propio paciente. Así enseñan a las células dendríticas cuál es el agresor.
Marta Santisteban, jefa de investigación, ha señalado que se está probando con un subgrupo de pacientes con cáncer de mama y que sabrán si es efectivo en mayo de 2012. En cualquier caso, complementaría la terapia convencional oncológica y no la cirugía, la radioterapia y la quimioterapia.
Además de la lucha contra el cáncer de mama, también se están probando vacunas para otros cánceres en otros cultivos como el de próstata, riñón, ovario, colon...
Sin embargo, Rodríguez considera que aunque se demuestre que las vacunas son efectivas, será difícil que la molécula se convierta en inhibidora y convencional. "La cuestión es que son autólogos, es decir, que se hacen con células del propio paciente. Por lo tanto, cada uno tiene que hacer lo suyo, y eso no está al alcance de todos, porque es muy caro".
Virus, caballo de Troya
Otra estrategia que está dando buenos resultados es la de los virus. Rodríguez explica en qué consiste: "Intentan transformar el genoma de los virus para que puedan destruir las células tumorales sin destruir las células normales. Son frecuentes los virus oncolíticos. A estos virus se les han modificado los genes para que sólo puedan entrar en las células tumorales. Al entrar en una célula tumoral, los virus no hacen más que dividirlos una y otra vez hasta que la célula explota".
En otras ocasiones se introduce un gen que codifica un tóxico. "De este modo, una vez introducidas en la célula, producen el tóxico y matan activamente a la célula. Armed viruses". Los virus armados.
Los virus oncolíticos y armados son ejemplos de terapia génica y sus investigaciones y ensayos clínicos están bastante avanzados. Otros que se están probando en la barra de terapia génica se encuentran en fases posteriores. Entre ellos se encuentran los ensayos de sustitución de genes mutados en células por genes sanos. En otros laboratorios se incluyen genes específicos en células tumorales para ser más sensibles a la radioterapia y a la quimioterapia. También hay quienes intentan introducir genes que impiden la angiogénesis, con los que los tumores no pueden producir y difundir vasos sanguíneos.
Son muchos los caminos que están probando los investigadores. Algunos todavía están en fase experimental, pero otros ya están muy avanzados y han sido autorizados para su uso. Hay cada vez más oportunidades que abren el camino a la esperanza.