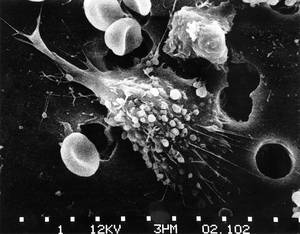
Del laboratori a la clínica

De la taula de treball a la capçalera del llit (from bench to bedside), així es coneix a la recerca dirigida directament a la teràpia, que s'està duent a terme en diversos laboratoris que investiguen en el tractament del càncer a tot el món. José Antonio Rodriguez va treballar en un d'aquests laboratoris fins fa quatre anys i, en la seva opinió, "és un concepte molt interessant".
José Antonio Rodríguez és ara professor del Departament de Genètica de la UPV. Va passar tres anys abans a Austràlia i altres set a Holanda en la recerca del càncer: "A Holanda vaig treballar en un hospital, no en la universitat. Treballava en el departament d'Oncologia Mèdica i allí tenen dues línies: en una d'elles tracten als pacients i en l'altra estudien els mecanismes dels medicaments en cèl·lules tumorals que es mantenen en els preparats de creixement. Jo vaig treballar en aquesta segona, perquè sóc biòleg, no mèdic, però les dues línies estan estretament relacionades".
Segons Rodríguez, aquesta manera de treballar és apropiada per a teràpies biològiques. "En la quimioteràpia, per exemple, els investigadors tracten de saber quina és la dosi màxima que poden donar i després donen als pacients una dosi inferior. Les teràpies biològiques, per part seva, són menys tòxiques i en elles moltes vegades no hi ha dosis màximes. La seva eficàcia ha de ser provada d'una altra manera. Es tracta de mesurar marcadors biològics (per exemple, la concentració d'una proteïna) i veure si el medicament interfereix amb la senyalització cel·lular que volem impedir".
El bloqueig d'aquestes senderes és la base sobre la qual s'assenten moltes de les teràpies que s'estan provant: la identificació dels mecanismes o senderes necessàries per al creixement, reproducció i difusió de les cèl·lules tumorals i la seva obstrucció mitjançant molècules desenvolupades en el laboratori. Segons explica Rodríguez, aquestes senderes també són utilitzats per cèl·lules convencionals, però no utilitzen una sola, sinó quatre o cinc, per a fer el mateix. Per contra, les cèl·lules tumorals tenen una sobreactivación en una d'elles i unes altres no les utilitzen perquè no les necessiten. "Aquesta senda de sobreactivación aporta avantatge a la cèl·lula però també un punt feble al mateix temps ( Taló d'Aquil·les ). Si bloquegem aquesta sendera que els dóna avantatge, la cèl·lula mor".
En la secció de Rodríguez, per exemple, investigaven als inhibidors de l'EGFRa. L'EGFR és un receptor situat en la superfície cel·lular ( epidermal growth factor receptor ) que controla que el gen que el controla estigui mutat o que la seva expressió sigui excessiva pot causar càncer. "El bloqueig de la senyalització d'EGFR impedeix el desenvolupament del càncer. Perquè els inhibidors provats per nosaltres ja s'utilitzen en els pacients. Un d'ells és l'erlotinib, utilitzat als hospitals per a tractar els càncers de pulmó". També s'estan provant molècules anti-COVs, el propi erlotinib o altres inhibidors en cervell, còlon i altres tipus de càncer, depenent del mecanisme de cada tipus de tumor.
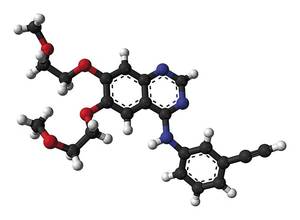
Cal tenir en compte que hi ha molts tipus de càncer. "Molts diuen que cada pacient té un tipus de càncer, el seu", diu Rodríguez. Per això, els investigadors han de buscar els inhibidors més adequats de tots els càncers. Per a això és necessari analitzar els defectes genètics (mutacions) que han originat el tumor.
La guerra a les resistències
En qualsevol cas, Rodríguez adverteix que aquesta estratègia té un límit: "El problema és que desenvolupen resistències als inhibidors".
Amb el temps, quan inhibim una senda, les cèl·lules tumorals comencen a utilitzar altres sendes que serveixen per a fer el mateix i es tornen resistents a l'inhibidor. Per això, han d'administrar-se de forma combinada.
En paraules de Rodríguez, "aquesta és una guerra, i quan es tanca un camí hem d'intentar per un altre". A més de la via dels inhibidors de les sendes, també és important la dels anticossos monoclonals. Inclou, per exemple, trastuzumab (Herceptina), anticòs contra un receptor similar a l'EGFR. Trastuzumab s'utilitza habitualment contra el càncer de mama i ara també està provant en assajos clínics altres tipus de càncer.

Aquests anticossos es generen en el laboratori i són capaços d'unir-se específicament a un antigen concret. Els anticossos monoclonals han estat utilitzats des de fa temps en el diagnòstic del càncer. A manera de teràpia, els investigadors intenten identificar en la superfície de les cèl·lules tumorals els antígens relacionats amb el creixement (p. ex. receptors de factors de creixement) i dissenyar els anticossos associats a ells. D'aquesta forma, els anticossos s'uneixen als antígens i les cèl·lules no poden créixer.
També s'utilitzen anticossos monoclonals dissenyats específicament per al foment del sistema immunitari.
Vacunes contra el càncer
En relació al sistema immunitari, una altra de les vies que s'estan investigant per a combatre el càncer és la vacunació.
Les vacunes utilitzades en malalties infeccioses s'administren abans de l'aparició de la malaltia. Aquestes vacunes contenen fragments d'antígens de l'agent infecciós o desactivats pel mateix agent i tenen com a objectiu preparar el sistema immunitari quan l'agent entra en el cos. D'alguna manera, les vacunes li ensenyen qui és l'agressor, la qual cosa permet al cos preparar les millors armes contra ell.
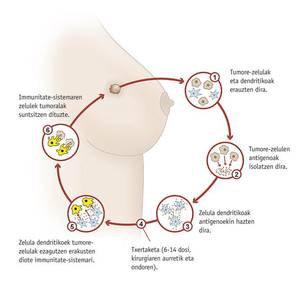
Les vacunes contra el càncer, no obstant això, s'utilitzarien després de l'aparició de la malaltia per a tractar-la o impedir la seva difusió. Un d'ells està sent provat en la Clínica Universitat de Navarra. L'objectiu de la vacuna és evitar l'aparició d'un càncer de mama després de ser tractat i per a això s'utilitzen cèl·lules dendríticas de la dona (cèl·lules del sistema immunitari) que són estimulades amb cèl·lules tumorals del propi pacient. Així ensenyen a les cèl·lules dendríticas quin és l'agressor.
Marta Santisteban, cap de recerca, ha assenyalat que s'està provant amb un subgrup de pacients amb càncer de mama i que sabran si és efectiu al maig de 2012. En qualsevol cas, complementaria la teràpia convencional oncològica i no la cirurgia, la radioteràpia i la quimioteràpia.
A més de la lluita contra el càncer de mama, també s'estan provant vacunes per a altres càncers en altres cultius com el de pròstata, ronyó, ovari, còlon...
No obstant això, Rodríguez considera que encara que es demostri que les vacunes són efectives, serà difícil que la molècula es converteixi en inhibidora i convencional. "La qüestió és que són autòlegs, és a dir, que es fan amb cèl·lules del propi pacient. Per tant, cadascun ha de fer el seu, i això no està a l'abast de tots, perquè és molt car".
Virus, cavall de Troia
Una altra estratègia que està donant bons resultats és la dels virus. Rodríguez explica en què consisteix: "Intenten transformar el genoma dels virus perquè puguin destruir les cèl·lules tumorals sense destruir les cèl·lules normals. Són freqüents els virus oncolíticos. A aquests virus se'ls han modificat els gens perquè només puguin entrar en les cèl·lules tumorals. En entrar en una cèl·lula tumoral, els virus no fan més que dividir-los una vegada i una altra fins que la cèl·lula explota".
En altres ocasions s'introdueix un gen que codifica un tòxic. "D'aquesta manera, una vegada introduïdes en la cèl·lula, produeixen el tòxic i maten activament a la cèl·lula. Armed viruses". Els virus armats.
Els virus oncolíticos i armats són exemples de teràpia gènica i les seves recerques i assajos clínics estan bastant avançats. Uns altres que s'estan provant en la barra de teràpia gènica es troben en fases posteriors. Entre ells es troben els assajos de substitució de gens mutats en cèl·lules per gens sans. En altres laboratoris s'inclouen gens específics en cèl·lules tumorals per a ser més sensibles a la radioteràpia i a la quimioteràpia. També hi ha els qui intenten introduir gens que impedeixen l'angiogénesis, amb els quals els tumors no poden produir i difondre vasos sanguinis.
Són molts els camins que estan provant els investigadors. Alguns encara estan en fase experimental, però uns altres ja estan molt avançats i han estat autoritzats per al seu ús. Hi ha cada vegada més oportunitats que obren el camí a l'esperança.