Notre corps, une arme puissante contre le cancer
Omaetxebarria Ibarra, Miren Josu
EHUko Biokimika eta Biologia Molekularra Saileko irakaslea eta ikertzailea
Les cellules sont des pièces de base de la vie; plus nous connaissons la structure, le fonctionnement et les interactions entre elles et avec leur environnement, plus nous les voyons comme des machines proches de la perfection. Ces cellules sont capables de se diviser en milliers d'occasions, et bien que le processus de division, complexe, est extrêmement précis, parfois des erreurs peuvent se produire. Les cellules disposent de nombreux mécanismes pour remédier à ces erreurs, mais, bien que rarement, dans certains cas, ces erreurs sont irréparables. Dans ces cas, les cellules peuvent être divisées incontrôlablement et les rendre immortels, c'est-à-dire développer un cancer.
Traditionnellement, le cancer a été attaqué par des agents chimiques et/ou radioactifs. Ces thérapies, en plus d'endommager l'ADN des cellules cancéreuses à croissance rapide, affectent également l'ADN des cellules saines, ce qui oblige à gérer pendant la thérapie leur toxicité et les effets secondaires désagréables. Ainsi, ces dernières années, la communauté scientifique et la communauté médicale prennent des mesures importantes pour développer des thérapies moins agressives, plus efficaces et spécifiques. En ce sens, l'immunothérapie est la plus importante. Le chemin parcouru par l'immunothérapie est si encourageant qu'en 2013 la revue Science l'a qualifiée de progrès annuel. L'immunothérapie ouvre une toute nouvelle voie pour traiter le cancer, dans laquelle au lieu d'avoir sa propre tumeur, le système immunitaire est recherché. Quand on parle d'immunité des tumeurs, on parle de l'efficacité de l'immunité antitumorale de l'hôte. Pour garantir cela, il est impératif que les différents types de cellules du système immunitaire agissent de manière coordonnée, car la réponse immunitaire est une conséquence complexe de multiples processus interconnectés.
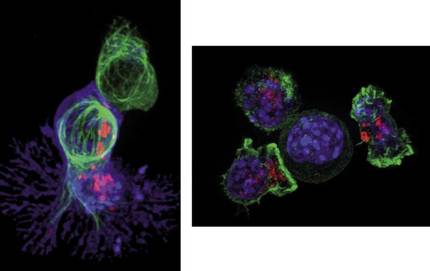
Dans cette complexité, les cellules T ou les lymphocytes T jouent un rôle important dans le développement de la réponse immunitaire. Des millions de cellules T voyagent à tout moment dans le sang en observant la présence d'éléments étrangers. Une cuillère à soupe de sang peut contenir environ 5 millions de cellules T, aussi petites que beaucoup. Ils ont une longueur moyenne de 10 micromètres, un dixième de l'épaisseur d'un cheveu humain. Chez les personnes en bonne santé, les lymphocytes T restent pendant le sommeil, mais lorsqu'un composant ou une cellule étrange est détecté, comme une cellule cancéreuse, les cellules T commencent à se diviser pour la combattre et la détruire. La figure 2 montre ce qui se passe lorsqu'une cellule T détecte une cellule cancéreuse. Une fois que la cellule T (en vert) rejoint la cellule cancéreuse (en bleu), la première incorpore des protéines « toxiques » (points rouges) connues sous le nom de cytotoxines. En conséquence, la cellule cancéreuse meurt et le lymphocyte T est prêt à rechercher sa prochaine victime.
Comme mentionné précédemment, avant de détruire l'élément étranger, les lymphocytes T sont fragmentés pour augmenter en nombre et rendre la réponse plus efficace. La petite molécule appelée interleucleukine 2 (IL-2), synthétisée par le système immunitaire lui-même, fournit le signal de début de la division des cellules T. Étant donné la capacité de l'IL-2 à reproduire des cellules T, il a été utilisé pour traiter une femme avec un cancer de la peau il y a trois décennies. Il s'agissait d'une femme qui avait été soumise à un certain nombre de traitements qui n'avaient supposé aucune amélioration. Dans le traitement avec IL-2 a été observé la mort massive des cellules sur le bord de la tumeur. Les tumeurs ont été contractées dans un délai de deux mois et après quelques mois, aucun signe de cancer n'a été détecté. Au cours des 29 prochaines années, la femme n'a pas développé d'autre cancer. C'était la première preuve de l'efficacité du traitement avec IL-2 et donc de la capacité du système immunitaire du patient à détruire les tumeurs. À partir de 1992, avec l'approbation de la Food and Drug Administration (FDA), l'IL-2 est le traitement habituel du cancer de la peau et du cancer du rein.
Astuces utilisées par les tumeurs pour éviter le système immunitaire
Mais pourquoi faut-il encourager la prolifération des cellules T ? Êtes-vous incapable de reconnaître et d'attaquer des cellules cancéreuses ? Malheureusement, la réponse est négative, et pour l'expliquer, nous devons nous pencher sur les particularités du micromsiège de la tumeur. Le cancer tentera d'échapper ou de modifier la réponse immunitaire de l'hôte pour assurer sa survie et son développement, provoquant, entre autres, l'inhibition des cellules T clés pour cela. Bien qu'il semble contradictoire, dans les tumeurs, en plus des lymphocytes T, il existe de nombreuses cellules du système immunitaire du malade, mais en raison des conditions particulières du microenvironnement de la tumeur, l'activité de ces cellules est difficile. Par exemple, dans les tumeurs, le nombre de molécules qui sécrètent les cellules cancéreuses elles-mêmes et qui entravent ou provoquent la mort des cellules immunitaires (tgf-beta, IL-10, prostaglandine E2, etc.) est énorme, tandis que la quantité d'oxygène présente dans la tumeur elle-même est faible et dans ces conditions les cellules tumorales développent des mécanismes de vie, mais les cellules immunitaires ne sont pas capables de le faire. En outre, dans cette tentative de fuir la réponse immunitaire, les cellules cancéreuses modifieront la composition moléculaire de leur surface, devenant invisibles pour le système immunitaire. Si cela ne suffisait pas, les cellules cancéreuses développent également la capacité de bloquer l'activité des cellules immunitaires (Figure 3). Tous ces mécanismes sont censés collaborer et limiter la capacité du système immunitaire à combattre le cancer en soi. Par conséquent, le dépassement de tous ces mécanismes est indispensable pour le développement d'immunothérapie plus efficace pour l'élimination du cancer. C'est la voie que l'on travaille actuellement: la manipulation de l'activité des cellules immunitaires pour surmonter les possibles conditions défavorables dans le microenvironnement de la tumeur et de détruire la tumeur. Parmi les approches les plus sophistiquées on trouve, d'une part, l'utilisation d'anticorps bloquants contre certains antigènes de cellules T et, d'autre part, l'utilisation de cellules T génétiquement modifiées. Ces deux principales stratégies sont celles qui ont été reconnues en 2013 par le magazine Science cité plus haut.
L'individu, l'arme la plus puissante pour attaquer le cancer
Comme déjà mentionné, les cellules immunitaires ne sont pas en mesure d'éliminer la tumeur, en grande partie parce que les cellules cancéreuses bloquent leur activité par une voie ou une autre. Les cellules immunitaires présentes dans les tumeurs, y compris les lymphocytes T, indiquent souvent des protéines ou des récepteurs spéciaux sur la surface. À leur tour, les cellules cancéreuses de tumeur peuvent représenter les molécules qui sont associées à ces récepteurs. Dans ces cas, des interactions se produisent entre les cellules cancéreuses et les lymphocytes T qui bloqueront l'activité des lymphocytes T (3A. Image).
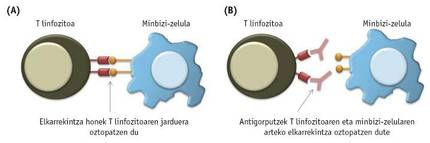
Pour éviter ces interactions nocives entre les cellules cancéreuses et les cellules T, plusieurs anticorps ont été synthétisés ces dernières années (3B. Image). Les tests effectués jusqu'à présent ont montré que les anticorps les plus efficaces sont associés aux récepteurs PD-1 et CTL4 des lymphocytes T. En 2011, la FDA a approuvé un médicament appelé ipilimumab qui bloque les récepteurs CTLA-4 pour traiter le cancer de la peau. Bien que les résultats obtenus à la fois dans l'ipilimumab et dans l'IL-2 aient été similaires au début, il a été observé que chez les patients traités avec ipilimumab le traitement est plus long. Opdivo ou nibolumab, un médicament qui bloque le récepteur PD-1 des lymphocytes T, a été approuvé par la FDA en 2014 pour traiter le mélanome, et un an plus tard, il a été accepté pour combattre le cancer du poumon.
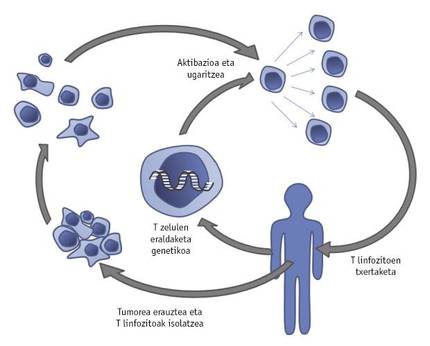
Le développement d'une stratégie innovante, appelée le transfert de cellules T adoptives, a également donné une grande impulsion à la lutte contre le cancer. Cette thérapie consiste à isoler les cellules T de la tumeur extraites du patient. Ces cellules T seront manipulées génétiquement par l'introduction de nouveaux gènes ou par la transformation de leurs propres afin qu'ils grandissent et agissent plus efficacement dans le micro-siège de la tumeur. Après avoir favorisé la croissance de lymphocytes T améliorés avec IL-2, le patient sera réintégré (figure 4).
La preuve en est celle d'un groupe de chercheurs de l'État américain du Maryland: Les cellules T ont été génétiquement modifiées pour représenter l'IL-12 qui produit l'inflammation. Une fois inséré dans la tumeur, les cellules T modifiées sécrètent IL-12, ce qui empêche l'activité des cellules cancéreuses qui interfèrent dans la réponse immunitaire. Compte tenu des résultats prometteurs obtenus dans les expériences réalisées avec la souris, les premiers tests cliniques avec des cellules T manipulées génétiquement indiquant IL-12, patients atteints de mélanome sont en cours. Un autre problème à surmonter est la mortalité excessive des lymphocytes T typique des tumeurs pour assurer une immunothérapie efficace. Pour le combattre, les lymphocytes T ont été génétiquement modifiés par une même équipe de recherche pour représenter la molécule Bcl-2 qui évite sa mort. En comparant les lymphocytes T représentant cette molécule à ceux non manipulés, il a été démontré que les premiers sont plus résistants à la mort. Comme mentionné précédemment, la réponse immunitaire dans le micromsiège de la tumeur est souvent obstruée par l'incapacité des cellules immunitaires à connaître la tumeur et, par conséquent, à combattre. À cet égard, il a été démontré qu'il est possible que les cellules T présentes dans les tumeurs soient manipulées génétiquement de façon permanente afin qu'elles expriment des molécules excitantes et, par conséquent, que les cellules T restent activées sans détecter leur propre tumeur et détruisent ainsi la tumeur.
Le succès de cette thérapie a été remarquable dès le début, et son efficacité augmente avec la recherche.
Il a été récemment démontré que la thérapie de transfert de cellules T adoptives est nettement plus efficace si elle est traitée par chimiothérapie ou radiothérapie aux patients cancérigènes avant de subir ce traitement. Ces thérapies éliminent la population lymphocytaire intrinsèque du patient, ce qui rend les cellules T génétiquement modifiées introduites capables d'agir plus efficacement et plus longtemps. Malheureusement, cela a des inconvénients, il ya des patients qui ne sont pas en mesure d'avancer dans cette situation sans cellules T.
Il reste encore beaucoup à améliorer
Bien que des progrès considérables aient été accomplis ces dernières années dans la recherche et la médecine, le cancer demeure l'une des maladies les plus mortelles au monde. Une connaissance approfondie des systèmes immunitaires sera indispensable pour développer des thérapies plus efficaces, spécifiques, durables et moins agressives. Il sera indispensable de réaliser des combinaisons entre différentes stratégies permettant d'affronter adéquatement une maladie aussi hétérogène du point de vue biologique.