El nostre cos, una poderosa arma contra el càncer
Omaetxebarria Ibarra, Miren Josu
EHUko Biokimika eta Biologia Molekularra Saileko irakaslea eta ikertzailea
Les cèl·lules són peces bàsiques de la vida; quant millor coneixem l'estructura, el funcionament i les interaccions entre elles i amb el seu entorn, més les veiem com a màquines pròximes a la perfecció. Aquestes cèl·lules són capaces de dividir-se en milers d'ocasions, i encara que el procés de divisió, complex, és extremadament precís, ocasionalment poden produir-se errors. Les cèl·lules disposen de molts mecanismes per a remeiar aquests errors, però, encara que amb poca freqüència, en alguns casos aquests errors són irreparables. En aquests casos, les cèl·lules es poden dividir incontroladament i fer-les immortals, és a dir, desenvolupar càncer.
Tradicionalment el càncer ha estat atacat per agents químics i/o radioactius. Aquestes teràpies, a més de danyar l'ADN de les cèl·lules canceroses de creixement ràpid, també afecten l'ADN de les cèl·lules sanes, la qual cosa obliga a gestionar durant la teràpia la seva toxicitat i els efectes secundaris desagradables. Així, en els últims anys la comunitat científica i la comunitat mèdica estan fent passos importants en el desenvolupament de teràpies menys agressives, més efectives i específiques. En aquest sentit, la immunoteràpia és la que més ha destacat. El camí recorregut per la immunoteràpia és tan esperançador que en 2013 la revista Science la va qualificar de progrés anual. La immunoteràpia obre una via completament nova per a tractar el càncer, en la qual en lloc de tenir el propi tumor, es busca el sistema immunitari. Quan parlem d'immunitat dels tumors parlem de l'eficàcia de la immunitat antitumoral de l'hoste. Per a garantir això, és imprescindible que els diferents tipus de cèl·lules del sistema immunitari actuïn de manera coordinada, ja que la resposta immune és una conseqüència complexa de múltiples processos interrelacionats.
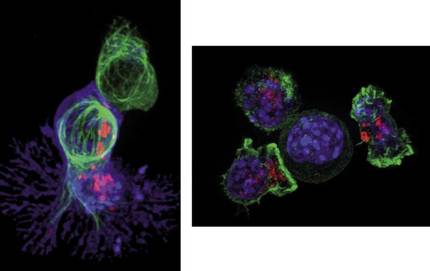
En aquesta complexitat, les cèl·lules T o els limfòcits T juguen un paper important en el desenvolupament de la resposta immunològica. Milions de cèl·lules T viatgen en tot moment per la sang observant la presència d'elements estranys. Una cullerada en sang pot contenir al voltant de 5 milions de cèl·lules T, tan petites com moltes. Tenen una longitud mitjana de 10 micròmetres, una desena part del gruix d'un cabell humà. En persones sanes, els limfòcits T romanen durant el somni, però quan es detecta un component o cèl·lula estrany, com una cèl·lula cancerosa, les cèl·lules T comencen a dividir-se amb l'objectiu de combatre-la i destruir-la. En la figura 2 es pot observar què ocorre quan una cèl·lula T detecta una cèl·lula cancerosa. Una vegada que la cèl·lula T (en verd) s'uneix a la cèl·lula cancerosa (en blava), la primera incorpora proteïnes “verinoses” (punts vermells) conegudes com citotoxinas. Com a conseqüència d'això, la cèl·lula cancerosa mor i el limfòcit T està disposat a buscar a la seva pròxima víctima.
Com s'ha comentat anteriorment, abans de destruir l'element estrany, els limfòcits T es fragmenten per a augmentar en número i fer més efectiva la resposta. La petita molècula denominada interleucleukina 2 (IL-2), sintetitzada pel propi sistema immunitari, proporciona el senyal d'inici de la divisió de les cèl·lules T. Donada la capacitat de l'IL-2 per a reproduir cèl·lules T, es va utilitzar per al tractament d'una dona amb càncer de pell fa tres dècades. Es tractava d'una dona que havia estat sotmesa a una sèrie de tractaments que no havien suposat cap millora. En el tractament amb IL-2 es va observar la mort massiva de cèl·lules en la vora del tumor. Els tumors es van contreure en un termini de dos mesos i després d'uns mesos no es van detectar signes de càncer. En els pròxims 29 anys la dona no ha desenvolupat cap altre càncer. Aquesta va ser la primera prova de l'eficàcia del tractament amb IL-2 i, per tant, de la capacitat del sistema immunitari del pacient per a destruir tumors. A partir de 1992, amb l'aprovació de l'Administració de Drogues i Aliments (FDA), la IL-2 és el tractament habitual del càncer de pell i del càncer renal.
Trucs utilitzats pels tumors per a evitar el sistema immunitari
Però, per què cal fomentar la proliferació de cèl·lules T? No són capaços de reconèixer i atacar cèl·lules canceroses? Lamentablement la resposta és negativa, i per a explicar-la hem de fixar-nos en les peculiaritats del micromedio del tumor. El càncer intentarà escapar o alterar la resposta immune de l'hoste per a assegurar la seva supervivència i desenvolupament, provocant, entre altres coses, la inhibició de les cèl·lules T clau per a això. Encara que sembli contradictori, en els tumors, a més dels limfòcits T, existeixen nombroses cèl·lules del sistema immunitari del malalt, però a causa de les especials condicions del microambiente del tumor, l'activitat d'aquestes cèl·lules està dificultada. Per exemple, en els tumors, el nombre de molècules que segreguen les pròpies cèl·lules canceroses i que dificulten o provoquen la mort de les cèl·lules immunitàries (tgf-beta, IL-10, prostaglandina E2, etc.) és enorme, mentre que la quantitat d'oxigen present en el propi tumor és escassa i en aquestes condicions les cèl·lules tumorals desenvolupen mecanismes de vida, però les cèl·lules immunitàries no són capaces de fer-ho. A més, en aquest intent de fugir de la resposta immune, les cèl·lules canceroses alteraran la composició molecular de la seva superfície, convertint-se en invisibles per al sistema immune. Si això no fos poc, les cèl·lules canceroses també desenvolupen la capacitat de bloquejar l'activitat de les cèl·lules immunitàries (Figura 3). Es creu que tots aquests mecanismes col·laboren i aconsegueixen limitar la capacitat del sistema immunitari per a combatre el càncer en si mateix. Per tant, la superació de tots aquests mecanismes és imprescindible per al desenvolupament d'immunoteràpia més efectives per a l'eliminació del càncer. Aquest és el camí que s'està treballant en l'actualitat: la manipulació de l'activitat de les cèl·lules immunitàries per a superar possibles condicions adverses en el microambiente del tumor i destruir el tumor. Entre les aproximacions més sofisticades es troben, d'una banda, l'ús d'anticossos bloqueantes contra determinats antígens de cèl·lules T i, per un altre, l'ús de cèl·lules T genèticament modificades. Aquestes dues principals estratègies són les que han estat reconegudes en 2013 per la revista Science abans citada.
L'individu, l'arma més poderosa per a atacar el càncer
Com ja s'ha comentat, les cèl·lules immunitàries no són capaces d'eliminar el tumor, en gran manera perquè les cèl·lules canceroses bloquegen la seva activitat per l'una o l'altra via. Les cèl·lules immunitàries presents en els tumors, entre elles els limfòcits T, sovint indiquen proteïnes o receptors especials en la superfície. Al seu torn, les cèl·lules cancerígenes del tumor poden representar les molècules que s'associen a aquests receptors. En aquests casos es produeixen interaccions entre cèl·lules canceroses i limfòcits T que bloquejaran l'activitat dels limfòcits T (3A. Imatge).
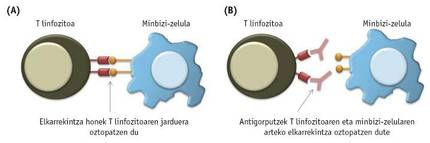
Per a evitar aquestes interaccions nocives entre cèl·lules cancerígenes i cèl·lules T, en els últims anys s'han sintetitzat diversos anticossos (3B. Imatge). Les proves realitzades fins al moment han demostrat que els més reeixits són els anticossos associats als receptors PD-1 i CTL4 dels limfòcits T. En 2011, el FDA va aprovar un fàrmac denominat ipilimumab que bloqueja als receptors CTLA-4 per a tractar el càncer de pell. Si bé al principi els resultats obtinguts tant en l'ipilimumab com en l'IL-2 van ser similars, posteriorment s'ha observat que en els pacients tractats amb ipilimumab el tractament és més prolongat. Opdivo o nibolumab, un fàrmac que bloqueja el receptor PD-1 dels limfòcits T, va ser aprovat per la FDA en 2014 per a tractar el melanoma, i un any després va ser acceptat per a combatre el càncer de pulmó.
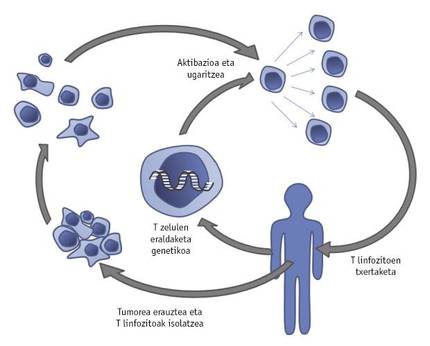
El desenvolupament d'una estratègia innovadora, denominada transferència de cèl·lules T adoptives, ha donat també un gran impuls a la lluita contra el càncer. Aquesta teràpia consisteix a aïllar les cèl·lules T del tumor extretes del pacient. Aquestes cèl·lules T seran manipulades genèticament mitjançant la introducció de nous gens o la transformació dels propis perquè creixin i actuïn de forma més eficaç en el micromedio del tumor. Després de promoure el creixement de limfòcits T millorats amb IL-2, es reincorporaran al pacient (Figura 4).
Prova d'això és la realitzada per un grup d'investigadors de l'estat nord-americà de Maryland: Les cèl·lules T van ser modificades genèticament perquè representessin l'IL-12 que produeix la inflamació. Una vegada inserit en el tumor, les cèl·lules T modificades segreguen IL-12, la qual cosa impedeix l'activitat de cèl·lules cancerígenes que interfereixen en la resposta immune. Tenint en compte els prometedors resultats obtinguts en els experiments realitzats amb el ratolí, s'estan realitzant les primeres proves clíniques amb cèl·lules T manipulades genèticament que indiquen IL-12, pacients amb melanoma. Un altre problema a superar és l'excés de mortalitat de limfòcits T típic dels tumors per a garantir immunoteràpia efectiva. Per a combatre-ho, els limfòcits T han estat modificats genèticament per un mateix equip de recerca perquè representin a la molècula Bcl-2 que evita la seva mort. Comparant els limfòcits T que representen aquesta molècula amb els no manipulats, es va demostrar que els primers són més resistents a la mort. Com ja s'ha esmentat anteriorment, en moltes ocasions la resposta immune en el micromedio del tumor està obstruïda per la incapacitat de les cèl·lules immunes per a conèixer el tumor i, per tant, combatre'l. En aquest sentit, s'ha demostrat que és possible que les cèl·lules T presents en els tumors siguin manipulades genèticament de manera permanent perquè expressin molècules excitants i, en conseqüència, que les cèl·lules T romanguin activades sense detectar el propi tumor i, d'aquesta manera, destrueixin el tumor.
L'èxit d'aquesta teràpia ha estat notable des del principi, i la seva eficàcia augmenta amb la recerca.
Recentment s'ha demostrat que la teràpia de transferència de cèl·lules T adoptives és significativament més eficaç si es tracta a través de quimioteràpia o radioteràpia a pacients cancerígens abans de sotmetre's a aquest tractament. Aquestes teràpies eliminen la població limfocitària intrínseca del pacient, la qual cosa fa que les cèl·lules T genèticament modificades introduïdes siguin capaces d'actuar de forma més eficaç i durant més temps. Desgraciadament això té desavantatges, hi ha pacients que no són capaços d'avançar en aquesta situació sense cèl·lules T.
Encara queda molt per millorar
A pesar que en els últims anys s'han produït importants avanços tant en recerca com en medicina, el càncer continua sent una de les malalties més mortals del món. Serà imprescindible un coneixement més profund dels sistemes immunitaris per a desenvolupar teràpies més eficaces, específiques, sostenibles i menys agressives. Serà imprescindible realitzar combinacions entre diferents estratègies que permetin afrontar adequadament una malaltia tan heterogènia des del punt de vista biològic.