Nuestro cuerpo, una poderosa arma contra el cáncer
Omaetxebarria Ibarra, Miren Josu
EHUko Biokimika eta Biologia Molekularra Saileko irakaslea eta ikertzailea
Las células son piezas básicas de la vida; cuanto mejor conocemos la estructura, el funcionamiento y las interacciones entre ellas y con su entorno, más las vemos como máquinas cercanas a la perfección. Estas células son capaces de dividirse en miles de ocasiones, y aunque el proceso de división, complejo, es extremadamente preciso, ocasionalmente pueden producirse errores. Las células disponen de muchos mecanismos para remediar estos errores, pero, aunque con poca frecuencia, en algunos casos estos errores son irreparables. En estos casos, las células se pueden dividir incontroladamente y hacerlas inmortales, es decir, desarrollar cáncer.
Tradicionalmente el cáncer ha sido atacado por agentes químicos y/o radiactivos. Estas terapias, además de dañar el ADN de las células cancerosas de crecimiento rápido, también afectan al ADN de las células sanas, lo que obliga a gestionar durante la terapia su toxicidad y los efectos secundarios desagradables. Así, en los últimos años la comunidad científica y la comunidad médica están dando pasos importantes en el desarrollo de terapias menos agresivas, más efectivas y específicas. En este sentido, la inmunoterapia es la que más ha destacado. El camino recorrido por la inmunoterapia es tan esperanzador que en 2013 la revista Science la calificó de progreso anual. La inmunoterapia abre una vía completamente nueva para tratar el cáncer, en la que en lugar de tener el propio tumor, se busca el sistema inmunitario. Cuando hablamos de inmunidad de los tumores hablamos de la eficacia de la inmunidad antitumoral del huésped. Para garantizar esto, es imprescindible que los diferentes tipos de células del sistema inmunitario actúen de forma coordinada, ya que la respuesta inmune es una consecuencia compleja de múltiples procesos interrelacionados.
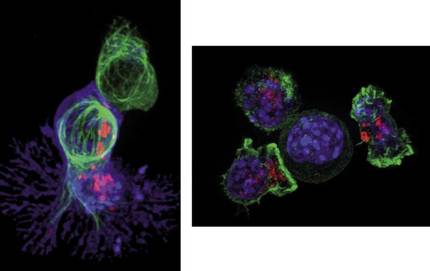
En esta complejidad, las células T o los linfocitos T juegan un papel importante en el desarrollo de la respuesta inmunológica. Millones de células T viajan en todo momento por la sangre observando la presencia de elementos extraños. Una cucharada en sangre puede contener alrededor de 5 millones de células T, tan pequeñas como muchas. Tienen una longitud media de 10 micrómetros, una décima parte del espesor de un cabello humano. En personas sanas, los linfocitos T permanecen durante el sueño, pero cuando se detecta un componente o célula extraño, como una célula cancerosa, las células T comienzan a dividirse con el objetivo de combatirla y destruirla. En la figura 2 se puede observar qué ocurre cuando una célula T detecta una célula cancerosa. Una vez que la célula T (en verde) se une a la célula cancerosa (en azul), la primera incorpora proteínas “venenosas” (puntos rojos) conocidas como citotoxinas. Como consecuencia de ello, la célula cancerosa muere y el linfocito T está dispuesto a buscar a su próxima víctima.
Como se ha comentado anteriormente, antes de destruir el elemento extraño, los linfocitos T se fragmentan para aumentar en número y hacer más efectiva la respuesta. La pequeña molécula denominada interleucleukina 2 (IL-2), sintetizada por el propio sistema inmunitario, proporciona la señal de inicio de la división de las células T. Dada la capacidad del IL-2 para reproducir células T, se utilizó para el tratamiento de una mujer con cáncer de piel hace tres décadas. Se trataba de una mujer que había sido sometida a una serie de tratamientos que no habían supuesto ninguna mejora. En el tratamiento con IL-2 se observó la muerte masiva de células en el borde del tumor. Los tumores se contrajeron en un plazo de dos meses y tras unos meses no se detectaron signos de cáncer. En los próximos 29 años la mujer no ha desarrollado ningún otro cáncer. Ésta fue la primera prueba de la eficacia del tratamiento con IL-2 y, por tanto, de la capacidad del sistema inmunitario del paciente para destruir tumores. A partir de 1992, con la aprobación de la Administración de Drogas y Alimentos (FDA), la IL-2 es el tratamiento habitual del cáncer de piel y del cáncer renal.
Trucos utilizados por los tumores para evitar el sistema inmunitario
Pero, ¿por qué hay que fomentar la proliferación de células T? ¿No son capaces de reconocer y atacar células cancerosas? Lamentablemente la respuesta es negativa, y para explicarla debemos fijarnos en las peculiaridades del micromedio del tumor. El cáncer intentará escapar o alterar la respuesta inmune del huésped para asegurar su supervivencia y desarrollo, provocando, entre otras cosas, la inhibición de las células T clave para ello. Aunque parezca contradictorio, en los tumores, además de los linfocitos T, existen numerosas células del sistema inmunitario del enfermo, pero debido a las especiales condiciones del microambiente del tumor, la actividad de estas células está dificultada. Por ejemplo, en los tumores, el número de moléculas que segregan las propias células cancerosas y que dificultan o provocan la muerte de las células inmunitarias (tgf-beta, IL-10, prostaglandina E2, etc.) es enorme, mientras que la cantidad de oxígeno presente en el propio tumor es escasa y en estas condiciones las células tumorales desarrollan mecanismos de vida, pero las células inmunitarias no son capaces de hacerlo. Además, en este intento de huir de la respuesta inmune, las células cancerosas alterarán la composición molecular de su superficie, convirtiéndose en invisibles para el sistema inmune. Si esto no fuera poco, las células cancerosas también desarrollan la capacidad de bloquear la actividad de las células inmunitarias (Figura 3). Se cree que todos estos mecanismos colaboran y consiguen limitar la capacidad del sistema inmunitario para combatir el cáncer en sí mismo. Por tanto, la superación de todos estos mecanismos es imprescindible para el desarrollo de inmunoterapia más efectivas para la eliminación del cáncer. Este es el camino que se está trabajando en la actualidad: la manipulación de la actividad de las células inmunitarias para superar posibles condiciones adversas en el microambiente del tumor y destruir el tumor. Entre las aproximaciones más sofisticadas se encuentran, por un lado, el uso de anticuerpos bloqueantes contra determinados antígenos de células T y, por otro, el uso de células T genéticamente modificadas. Estas dos principales estrategias son las que han sido reconocidas en 2013 por la revista Science antes citada.
El individuo, el arma más poderosa para atacar el cáncer
Como ya se ha comentado, las células inmunitarias no son capaces de eliminar el tumor, en gran medida porque las células cancerosas bloquean su actividad por una u otra vía. Las células inmunitarias presentes en los tumores, entre ellas los linfocitos T, a menudo indican proteínas o receptores especiales en la superficie. A su vez, las células cancerígenas del tumor pueden representar las moléculas que se asocian a estos receptores. En estos casos se producen interacciones entre células cancerosas y linfocitos T que bloquearán la actividad de los linfocitos T (3A. Imagen).
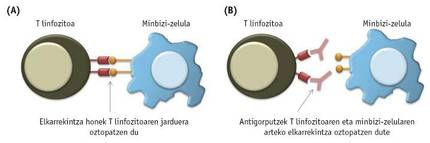
Para evitar estas interacciones nocivas entre células cancerígenas y células T, en los últimos años se han sintetizado varios anticuerpos (3B. Imagen). Las pruebas realizadas hasta el momento han demostrado que los más exitosos son los anticuerpos asociados a los receptores PD-1 y CTL4 de los linfocitos T. En 2011, el FDA aprobó un fármaco denominado ipilimumab que bloquea a los receptores CTLA-4 para tratar el cáncer de piel. Si bien en un principio los resultados obtenidos tanto en el ipilimumab como en el IL-2 fueron similares, posteriormente se ha observado que en los pacientes tratados con ipilimumab el tratamiento es más prolongado. Opdivo o nibolumab, un fármaco que bloquea el receptor PD-1 de los linfocitos T, fue aprobado por la FDA en 2014 para tratar el melanoma, y un año después fue aceptado para combatir el cáncer de pulmón.
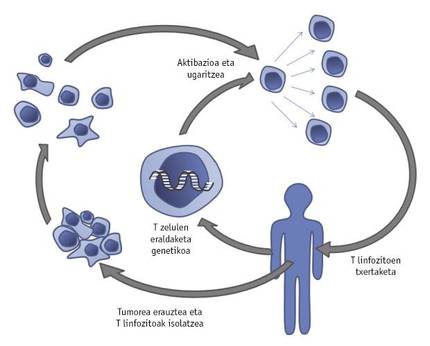
El desarrollo de una estrategia innovadora, denominada transferencia de células T adoptivas, ha dado también un gran impulso a la lucha contra el cáncer. Esta terapia consiste en aislar las células T del tumor extraídas del paciente. Estas células T serán manipuladas genéticamente mediante la introducción de nuevos genes o la transformación de los propios para que crezcan y actúen de forma más eficaz en el micromedio del tumor. Tras promover el crecimiento de linfocitos T mejorados con IL-2, se reincorporarán al paciente (Figura 4).
Prueba de ello es la realizada por un grupo de investigadores del estado norteamericano de Maryland: Las células T fueron modificadas genéticamente para que representaran el IL-12 que produce la inflamación. Una vez insertado en el tumor, las células T modificadas segregan IL-12, lo que impide la actividad de células cancerígenas que interfieren en la respuesta inmune. Teniendo en cuenta los prometedores resultados obtenidos en los experimentos realizados con el ratón, se están realizando las primeras pruebas clínicas con células T manipuladas genéticamente que indican IL-12, pacientes con melanoma. Otro problema a superar es el exceso de mortalidad de linfocitos T típico de los tumores para garantizar inmunoterapia efectiva. Para combatirlo, los linfocitos T han sido modificados genéticamente por un mismo equipo de investigación para que representen a la molécula Bcl-2 que evita su muerte. Comparando los linfocitos T que representan esta molécula con los no manipulados, se demostró que los primeros son más resistentes a la muerte. Como ya se ha mencionado anteriormente, en muchas ocasiones la respuesta inmune en el micromedio del tumor está obstruida por la incapacidad de las células inmunes para conocer el tumor y, por tanto, combatirlo. En este sentido, se ha demostrado que es posible que las células T presentes en los tumores sean manipuladas genéticamente de forma permanente para que expresen moléculas excitantes y, en consecuencia, que las células T permanezcan activadas sin detectar el propio tumor y, de esta manera, destruyan el tumor.
El éxito de esta terapia ha sido notable desde el principio, y su eficacia aumenta con la investigación.
Recientemente se ha demostrado que la terapia de transferencia de células T adoptivas es significativamente más eficaz si se trata a través de quimioterapia o radioterapia a pacientes cancerígenos antes de someterse a este tratamiento. Estas terapias eliminan la población linfocitaria intrínseca del paciente, lo que hace que las células T genéticamente modificadas introducidas sean capaces de actuar de forma más eficaz y durante más tiempo. Desgraciadamente esto tiene desventajas, hay pacientes que no son capaces de avanzar en esta situación sin células T.
Todavía queda mucho por mejorar
A pesar de que en los últimos años se han producido importantes avances tanto en investigación como en medicina, el cáncer sigue siendo una de las enfermedades más mortales del mundo. Será imprescindible un conocimiento más profundo de los sistemas inmunitarios para desarrollar terapias más eficaces, específicas, sostenibles y menos agresivas. Será imprescindible realizar combinaciones entre diferentes estrategias que permitan afrontar adecuadamente una enfermedad tan heterogénea desde el punto de vista biológico.