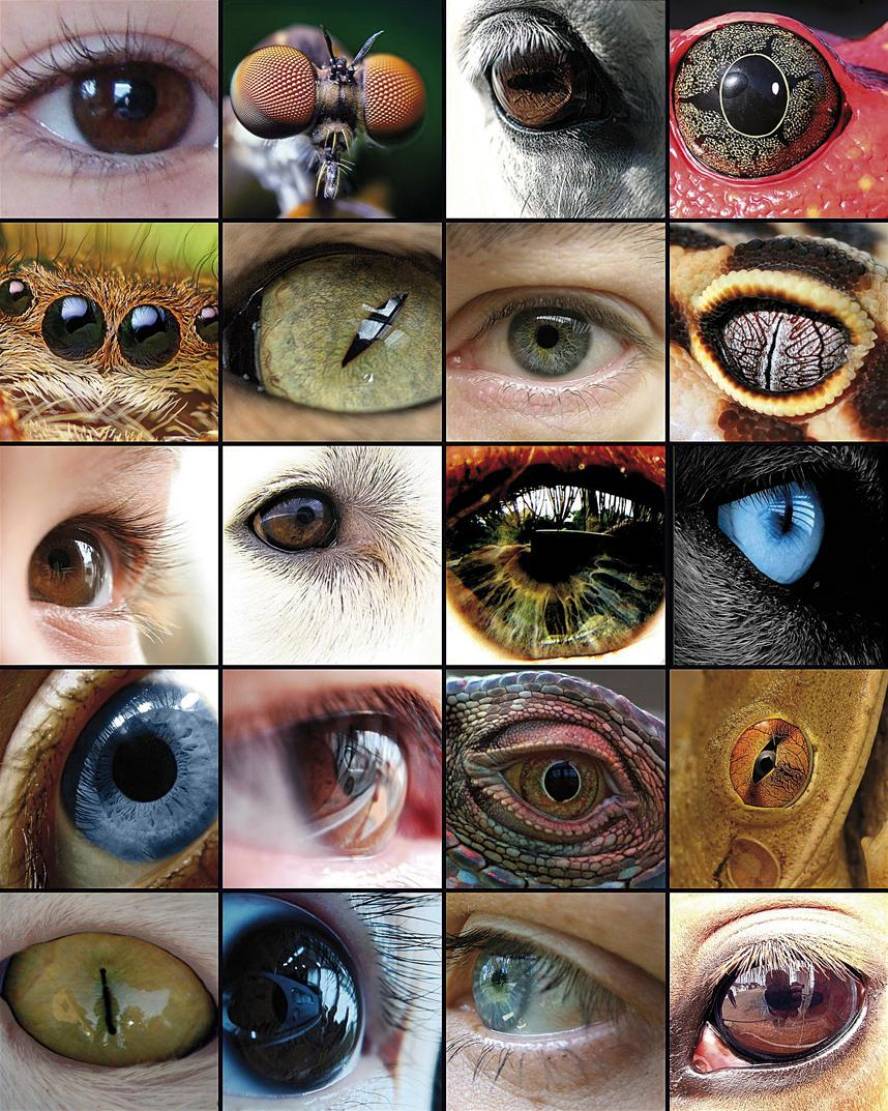
Regardant à l'oeil
L'évolution de l'œil a été la base de nombreuses études, car il est un exemple représentatif de l'organe homologue dans les différents taxons. Bien que certains composants oculaires, tels que les pigments visuels, semblent avoir un précurseur commun, les yeux capables de produire des images complexes ont évolué entre 50 et 100 fois, en utilisant les mêmes protéines et gènes de façon récurrente.
Charles Darwin lui-même a reconnu dans son livre L'origine des espèces (1882) qu'il avait de grandes difficultés à expliquer l'évolution de l'œil et a consacré un chapitre complet à l'œil sous le titre Les difficultés de la théorie en disant: "Le fait qu'un organe aussi complexe que l'œil ait été créé par choix semble certainement une folie énorme". Mais puis il continua ainsi: C'est pourquoi, si d'un œil simple et imparfait se produisaient les changements nécessaires pour créer l'œil parfait et complexe d'aujourd'hui, tel qu'il s'est produit en réalité, et si les animaux porteurs de ces changements étaient utiles à l'environnement changeant de la vie, le fait que nos yeux complexes parfaits se formaient par sélection naturelle, même si dépasse notre imagination, ne semble pas une idée si révolutionnaire ».
Origine des cellules photoréceptrices dans les métazoos
Les cellules photoréceptrices sont des cellules nerveuses de rétine capables d'effectuer la phototransduction. Les photorécepteurs sont d'une grande importance biologique par absorption de photons et la réalisation de nombreux sentiers biochimiques complexes qui convertissent le signal reçu en image dans le cerveau.
Il existe deux hypothèses pour expliquer l'origine des cellules photoréceptrices des métazoos : la première est basée sur la différenciation et la seconde sur la symbiose. Selon la première hypothèse, les métazoos ont été formés à partir d'une colonie de flagellés, et toutes les cellules avaient dès le début un organe photorécepteur. Cet organites photorécepteur agissait comme une cicatrice oculaire et comme réponse à la phototaxis qui transmettait les signaux à travers le fléau.
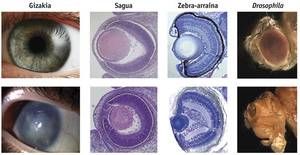
Selon l'hypothèse de la symbiose, ils ont leur origine dans des flagellés tels que Volvox ou Chlamydomonas, dans lesquels l'organe photosensible se trouve dans les chloroplastes, ce qui suggère que la perception de la lumière se trouve dans une évolution à partir des cyanobactéries et qu'elle est ensuite intégrée comme chloroplaste dans les cellules eucariotes. Une autre preuve en faveur de cette hypothèse, a expliqué Greuet en 1965, en décrivant les organites photorécepteurs de dinoflagelados tels que Erythropsis et Warpetia, aussi développés que l'œil humain mais ajoutés à l'intérieur d'une seule cellule, avec une surface similaire à la cornée, une structure similaire aux lentilles, une autre semblable à la rétine et organites pigments. Les dinoflagelados, en raison des symbiontes communs de coraux, d'anémones marines et d'autres cnidaires, auraient pu transférer aux cnidaires les gènes nécessaires pour répondre à la lumière, ce qui expliquerait l'apparition soudaine de l'œil aux cnidaires.
Selon l'hypothèse des Sinbiontes, la sensibilité à la lumière a d'abord émergé dans les cyanobactéries. Ces cyanobactéries ont été intériorisées par des cellules eucariotes d'algues rouges comme chloroplastes primaires. Par la suite, les algues rouges sont devenues symbiotiques avec des dinoflagellés comme chloroplastes secondaires. Dans certaines espèces de dinoflagelados, comme Erythropsis et Warpetia, on n'a pas trouvé de chloroplastes secondaires qui auraient évolué et sont devenus des organites photorécepteurs efficaces, comme le suggère Greuet. Enfin, comme les dinoflagelados sont des synbiontes communs aux cnidaires, ils ont transmis à ceux-ci les gènes des photorécepteurs. Ce dernier est le pas le plus incertain du modèle, bien que plusieurs gènes des dinoflagelados intégrés dans le génome des cnidaires ont été trouvés.
Analyse du développement des yeux
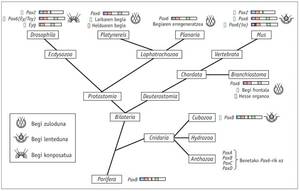
Chez les animaux, il est facile de détecter les mutations affectant le développement de l'œil et la mutation eyeless (ey) dans la mouche Drosophila a été découverte en 1915 par le chercheur Hoge. La souris a trouvé une mutation similaire et a été appelée small eye parce que les animaux hétérozygotes avaient les yeux très réduits, tandis que les fœtus homozygotes qui mouraient dans l'utérus manquaient les yeux, mais aussi le nez et certaines parties du cerveau (Hill et al ., 1991).
Chez l'homme, un syndrome héréditaire appelé aniridie produit un phénotype très similaire. Les gènes Small eye et aniridia ont été clonés par Walther et Gruss (1991) et Ton et son groupe (1991) respectivement, et ont vu que tous deux répondaient au gène Pax6 extrêmement conservé. Quiring et son équipe (1994) ont cloné l'homologue Pax6 de Drosophila et ont vu étonné que l'eyeless (ey) de Hoge était égal au gène. L'existence de mutations de gènes homologues Small eye, aniridia e eyeless indiquait que le gène Pax6 était le principal gène de contrôle du développement oculaire aussi bien dans les vertébrés que les invertébrés.
Pour démontrer cette hypothèse, le chercheur WJ Gehring a réussi en 1994 la mutation de la surexpression du gène Pax6, en créant des structures oculaires ectopiques qui exprimeraient le gène Pax6. Deux de ses collaborateurs, George Hager et Patrick Callaerts, ont utilisé le facteur de transcription Gal14 de levures pour transférer l'eyeless cDNA à des structures en dehors du disque d'oeil.
Les deux collaborateurs ont réussi à créer des structures visuelles ectopiques sur des antennes, des pattes et des ailes. Par la suite, des rétinogrammes ont montré que certains des yeux apparaissant sur les antennes étaient entièrement fonctionnels (Halder et al. , 1995). Ils ont également observé que le gène Pax6 de la souris était capable de l'insérer dans la Drosophile pour produire des yeux ectopiques (Gehring et al. , 1994).
Ces expériences ont montré que Pax6 était le principal gène de contrôle et que ce gène « stimulant » pouvait déclencher la morphogenèse de l'œil, tant chez les mammifères que chez les insectes.
Les gènes homologues de Pax6 ont été trouvés sur tous les animaux bilatéraux étudiés, de la planète à l'homme, y compris C. elegans. Des tests ont été réalisés avec différents animaux et il a été prouvé que le gène Pax6 d'entre eux est capable d'induire les yeux ectopiques chez Drosophila. La seule exception de cette loi est la tigrine planaire Dugesia, qui s'est beaucoup éloigné. Quant aux cnidaires, seuls quelques hydrozoos ont les yeux et on ne sait pas si le reste des méduses ont perdu leurs yeux tout au long de l'évolution ou ne les ont jamais eus.
Vision des couleurs
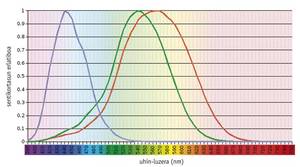
Des études montrent que le système de vision en couleur est une question ancestrale, car dès le début il existait un pigment visuel (appelé S) moulé pour absorber la lumière à 500 nm et un autre (L) adapté à 500 nm (Mollon, 1989). La rodopsine, un pigment aussi ancien que ceux-ci, a une capacité d'absorption maximale d'environ 500 nm et n'a aucun effet sur la vision en couleur. En général, les pigments nécessaires à la vision des couleurs se trouvent dans les cônes photorécepteurs, étant fonctionnels uniquement sous l'influence de la lumière. D'autre part, la rodopsine se trouve dans les bâtons photorécepteurs et travaille dans l'obscurité.
Les vertébrés actuels montrent une grande variabilité dans leur capacité visuelle, depuis la densité et la distribution spatiale des différents types de cônes jusqu'à l'absorption maximale des pigments des cônes (Yokoyama, 1998). À l'une des extrémités, la plupart des mammifères ne contiennent que trois pigments: deux pigments précurseurs de cône et de la rodopsine. À l'autre extrémité évolutionnaire, les poulets ont six pigments.
Selon des études menées sur les vertébrés les plus anciens, comme les hors-la-loi, le précurseur commun des téléostéens et des amniotes avait quatre types de photopigments, tout comme les oiseaux et les reptiles actuels (Bowmaker, 1998). Cependant, on croit qu'en raison du caractère nocturne des mammifères prématurés, deux photopigments ont été perdus tout au long de l'évolution, et la plupart des mammifères euthériens actuels ne conservent que des photopigments S et L, c'est-à-dire sont dichromatiques.
Les humains et leurs primates les plus proches montrent un modèle de complexité moyenne. Les humains ont quatre pigments visuels: Un seul membre de la famille S (bleu), deux photopigments de la famille L (vert ou LM et rouge ou LL) et rodopsine.
La vision trichromatique est d'une grande importance pour les primates et a été liée à l'avantage de trouver de la nourriture dans les forêts. Les travaux les plus récents ont démontré l'importance écologique de la trikromatie en comparant sa capacité d'adaptation à la forêt de singes bichromatiques et trichromatiques. Dans tous les primates, le photopigment S est codé par un gène autosomique, tandis que le photopigment L est codé dans le chromosome X. Dans les primates anthropiques et les singes ulaires du Vieux Monde, la trichromatie surgit par la duplication du gène L, donnant lieu au gène LM. Cependant, dans la plupart des primates du Nouveau Monde, le chromosome X est le seul gène de la famille L. Dans la mesure où le gène est associé à X, les femelles hétérozygotiques sont trichromatiques, et les femelles homozygotes et mâles, dichromatiques (blinds vert/rouge) (Jacobs, 1998).