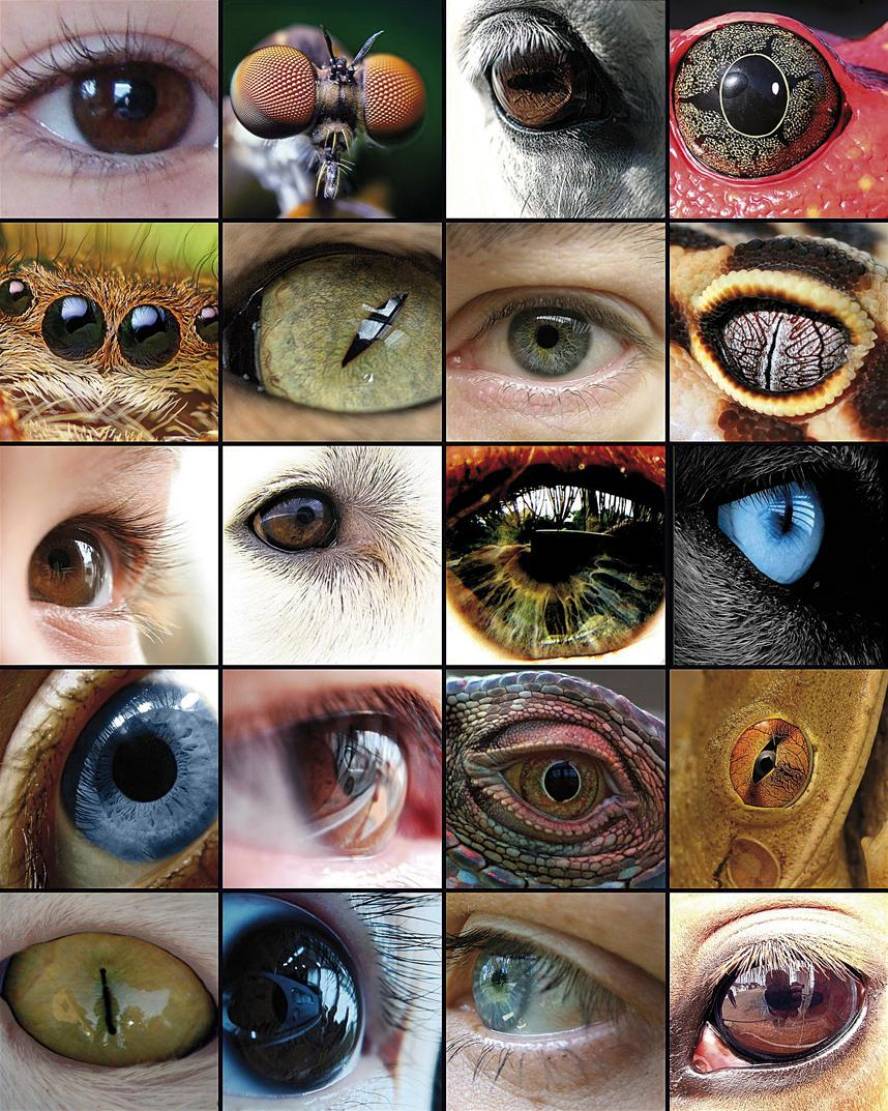
Mirando al ojo
La evolución del ojo ha sido la base de numerosos estudios, ya que es un ejemplo representativo del órgano homólogo en los diferentes taxones. Aunque algunos componentes del ojo, como los pigmentos visuales, parecen tener un precursor común, los ojos capaces de producir imágenes complejas han evolucionado entre 50 y 100 veces, recurriendo a las mismas proteínas y genes de forma recurrente.
El propio Charles Darwin reconocía en su libro El origen de las especies (1882) que tenía grandes dificultades para explicar la evolución del ojo y dedicó un capítulo completo al ojo bajo el título Las dificultades de la teoría diciendo: "el hecho de que un órgano tan complejo como el ojo haya sido creado por elección parece, ciertamente, una locura enorme". Pero luego seguía así: "Por eso, si de un ojo simple e imperfecto se produjeron los cambios necesarios para crear el ojo perfecto y complejo de hoy, tal y como se han producido en realidad, y si a los animales portadores de esos cambios les resultaban útiles ante el entorno cambiante de la vida, el hecho de que nuestros ojos complejos perfectos se formaran por selección natural, aunque supere nuestra imaginación, no parece una idea tan revolucionaria".
Origen de las células fotorreceptoras en los metazoos
Las células fotorreceptoras son células nerviosas de la retina capaces de llevar a cabo la fototransducción. Los fotorreceptores son de gran importancia biológica mediante la absorción de fotones y la realización de numerosos senderos bioquímicos complejos que convierten la señal recibida en imagen en el cerebro.
Existen dos hipótesis para explicar el origen de las células fotorreceptoras de los metazoos: la primera se basa en la diferenciación y la segunda en la simbiosis. Según la primera hipótesis, los metazoos se formaron a partir de una colonia de flagelados, y todas las células tenían desde el principio un orgáculo fotorreceptor. Este orgánulos fotorreceptor actuaba como cicatriz ocular y como respuesta a la fototaxis que transmitía las señales a través del flagelo.
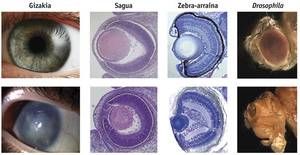
Según la hipótesis de la simbiosis, tienen su origen en flagelados como Volvox o Chlamydomonas, en los que el orgáculo fotosensible se encuentra en cloroplastos, lo que sugiere que la percepción de la luz se encuentra en una evolución a partir de las cianobacterias y que posteriormente se integra como cloroplasto en células eucariotas. Otra prueba a favor de esta hipótesis, explicó Greuet en 1965, al describir los orgánulos fotorreceptores de dinoflagelados como Erythropsis y Warnovia, tan desarrollados como el ojo humano pero agregados en el interior de una sola célula, con una superficie similar a la córnea, una estructura similar a las lentes, otra similar a la retina y orgánulos pigmentos. Los dinoflagelados, debido a los simbiontes comunes de corales, anémonas marinas y otros cnidarios, podían haber transferido a los cnidarios los genes necesarios para responder a la luz, lo que explicaría la aparición súbita del ojo a los cnidarios.
Según la hipótesis de los Sinbiontes, la sensibilidad a la luz surgió primero en las cianobacterias. Estas cianobacterias fueron interiorizadas por células eucariotas de algas rojas como cloroplastos primarios. Posteriormente, las algas rojas pasaron a estar en simbiosis con dinoflagelados como cloroplastos secundarios. En algunas especies de dinoflagelados, como Erythropsis y Warnovia, no se han encontrado cloroplastos secundarios que se cree que evolucionaron y se convirtieron en orgánulos fotorreceptores efectivos, como sugiere Greuet. Por último, y dado que los dinoflagelados son sinbiontes comunes a los cnidarios, transmitieron a éstos los genes de los fotorreceptores. Este último es el paso más incierto del modelo, aunque se han encontrado varios genes de los dinoflagelados integrados en el genoma de los cnidarios.
Análisis del desarrollo del ojo
En los animales es fácil detectar mutaciones que afectan al desarrollo del ojo y la mutación eyeless (ey) en la mosca Drosophila fue descubierta por primera vez en 1915 por el investigador Hoge. En el ratón se encontró una mutación parecida y se denominó small eye porque los animales heterocigóticos tenían los ojos muy reducidos, mientras que los fetos de homocigótanos que morían en el útero faltaban los ojos, pero también la nariz y algunas partes del cerebro (Hill et al ., 1991).
En el hombre, un síndrome hereditario llamado aniridia produce un fenotipo muy parecido. Los genes Small eye y aniridia fueron clonados por Walther y Gruss (1991) y Ton y su grupo (1991) respectivamente, y vieron que ambos respondían al gen Pax6 extremadamente conservado. Quiring y su equipo (1994) clonaron al homólogo Pax6 de Drosophila y vieron sorprendido que el eyeless (ey) de Hoge era igual al gen. La existencia de mutaciones de genes homólogos Small eye, aniridia e eyeless indicaba que el gen Pax6 era el principal gen de control del desarrollo ocular tanto en vertebrados como invertebrados.
Para demostrar esta hipótesis, el investigador WJ Gehring logró en 1994 la mutación de la sobreexpresión del gen Pax6, creando estructuras oculares ectópicas que expresarían el gen Pax6. Dos de sus colaboradores, George Hager y Patrick Callaerts, utilizaron el factor de transcripción Gal14 de levaduras para transferir el eyeless cDNA a estructuras fuera del disco de ojo.
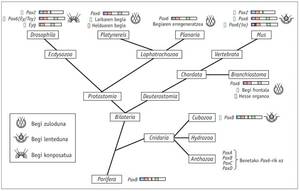
Los dos colaboradores lograron crear estructuras visuales ectópicas en antenas, patas y alas. Posteriormente, mediante retinogramas se demostró que algunos de los ojos que aparecían en las antenas eran totalmente funcionales (Halder et al. , 1995). Asimismo, observaron que el gen Pax6 del ratón era capaz de insertarlo en el Drosophila para producir ojos ectópicos (Gehring et al. , 1994).
Estos experimentos demostraron que Pax6 era el principal gen de control y que este gen "estimulante" podía dar inicio a la morfogénesis del ojo, tanto en mamíferos como en insectos.
Los genes homólogos de Pax6 se han encontrado en todos los animales bilaterales estudiados, desde el planeta al hombre, incluyendo C. elegans. Se han realizado pruebas con diferentes animales y se ha comprobado que el gen Pax6 de todos ellos es capaz de inducir los ojos ectópicos en Drosophila. La única excepción de esta ley es la tigrina planaria Dugesia, que se ha alejado mucho. En cuanto a los cnidarios, sólo algunos hidrozoos tienen los ojos y no se sabe si el resto de las medusas han perdido sus ojos a lo largo de la evolución o nunca los han tenido.
Visión de colores
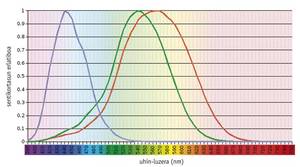
Hay estudios que demuestran que el sistema de visión en color es una cuestión ancestral, ya que desde el <500 nm-ra argia xurgatzeko moldaturiko ikusmen-pigmentu bat (S deiturikoa) eta > principio existían un pigmento visual (llamado S) moldeado para absorber la luz a <500 nm y otro (L) adaptado a > 500 nm (Mollon, 1989). La rodopsina, un pigmento tan antiguo como estos, tiene una capacidad de absorción máxima de unos 500 nm y no tiene ningún efecto en la visión en color. En general, los pigmentos necesarios para la visión del color se encuentran en los conos fotorreceptores, siendo funcionales únicamente bajo la influencia de la luz. Por otro lado, la rodopsina se encuentra en los palos fotorreceptores y trabaja en la oscuridad.
Los vertebrados actuales muestran una gran variabilidad en su capacidad visual, desde la densidad y distribución espacial de los diferentes tipos de conos hasta la absorción máxima de los pigmentos de los conos (Yokoyama, 1998). En uno de los extremos, la mayoría de los mamíferos sólo contienen tres pigmentos: dos pigmentos precursores de cono y rodopsina. En el otro extremo evolutivo, los pollos tienen seis pigmentos.
Según estudios realizados en los vertebrados más antiguos, como los forajidos, el precursor común de los teleosteos y los amniotas tenía cuatro tipos de fotopigmentos, al igual que las aves y reptiles actuales (Bowmaker, 1998). Sin embargo, se cree que debido al carácter nocturno de los mamíferos prematuros se perdieron dos fotopigmentos a lo largo de la evolución, y la mayoría de los mamíferos euterio actuales sólo mantienen fotopigmentos S y L, es decir, son dicromáticos.
Los seres humanos y sus primates más cercanos muestran un modelo de complejidad media. Los seres humanos tienen cuatro pigmentos visuales: Un solo miembro de la familia S (azul), dos fotopigmentos de la familia L (verde o LM y rojo o LL) y rodopsina.
La visión tricromática es de gran importancia para los primates y se ha relacionado con la ventaja de encontrar comida en los bosques. Las obras más recientes han demostrado la importancia ecológica de la trikromacia comparando su capacidad de adaptación al bosque de monos bicromáticos y tricromáticos. En todos los primates, el fotopigmento S es codificado por un gen autosómico, mientras que el fotopigmento L está codificado en el cromosoma X. En los primates antropoidea y monos ularios del Viejo Mundo, la tricromacia surge por la duplicación del gen L, dando lugar al gen LM. Sin embargo, en la mayoría de los primates del Nuevo Mundo, el cromosoma X es el único gen de la familia L. En la medida en que el gen está asociado a X, las hembras heterocigóticas son tricromáticas, y las hembras homocigóticas y machas, dicromáticas (ciegas de verde/rojo) (Jacobs, 1998).