Adipocitos, obesidad y salud: relación más compleja de lo esperado
Nutrizioa eta Obesitatea ikerketa taldea (EHU) CIBEROBN eta BIOARABA Osasun Institutuak
Nutrizioa eta Obesitatea taldea, EHU. CIBERobn, Carlos III Osasun Institutua. BIOARABA Osasunaren Ikerketa Zentroa
Pero empecemos por el principio. La obesidad es una enfermedad crónica caracterizada por una acumulación excesiva de grasa que puede ser perjudicial para la salud. A pesar de tratarse de una enfermedad multifactorial, los hábitos alimenticios y los factores ambientales se consideran como factores principales (estilo de vida sedentario e ingestión energética excesiva) [1]. El desarrollo de la obesidad requiere un desequilibrio entre el consumo y el gasto energético, que se alarga en el tiempo. Este exceso de energía se acumula en las unidades funcionales del tejido adiposo, adipocitos, en forma de triglicéridos, mediante dos mecanismos: la hipertrofia de los adipocitos (aumento de tamaño de los adipocitos para acumular excedentes energéticos) y la hiperplasia de los adipocitos (aumento del número de adipocitos). A pesar de que desde hace tiempo se conoce el papel que desempeñan los adipocitos en la acumulación de energía, no hemos hecho más que tomar conciencia de la importancia que tienen estas células de tejido adiposo en el mantenimiento de la homeostasis metabólica del cuerpo [2].
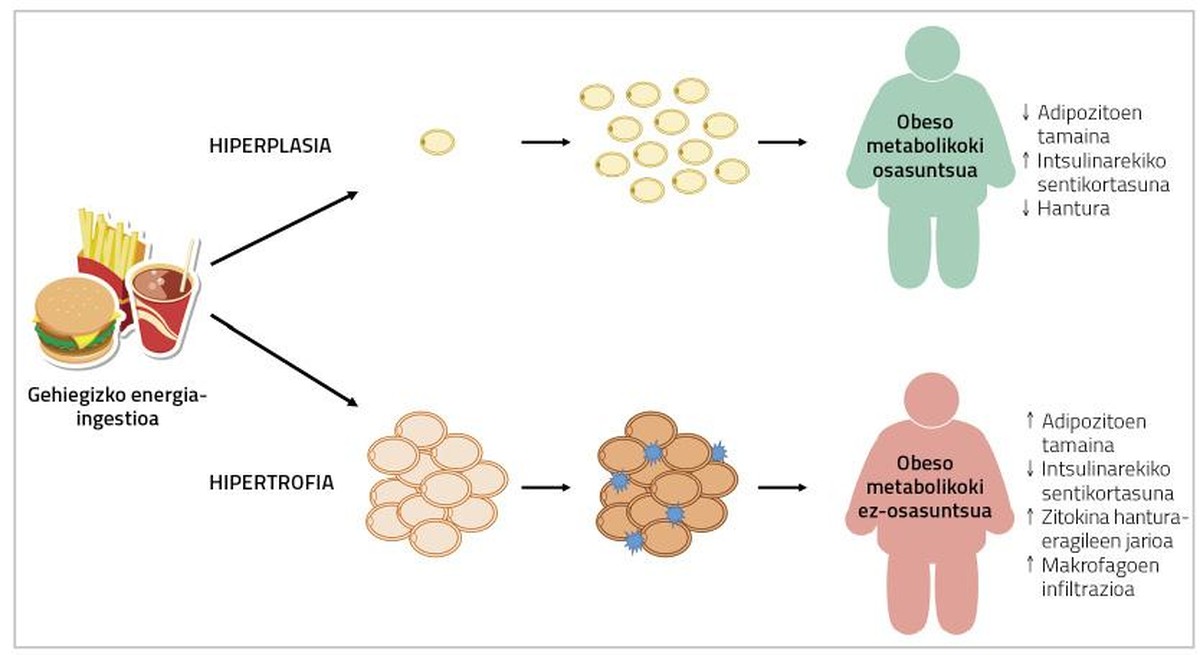
En general, la capacidad de hipertrofia de los adipocitos se relaciona con la obesidad que se desarrolla en la edad adulta, mientras que la hiperplasia se ha considerado como el mecanismo impulsor de la obesidad infantil y juvenil. De hecho, hasta hace poco se pensaba que el número de adipocitos de un tejido graso era limitado y se mantenía constante desde la infancia hasta la madurez [3]. Sin embargo, en estudios recientes con roedores se ha observado que en la edad adulta también se producen nuevos adivenitos al abusar de la energía. Estos nuevos adipocitos surgen de la diferenciación de los adipocitos inmaduros y participan en la difusión del tejido adiposo (hiperplasia) [4]. Pero, a pesar de ello, ¿qué relación tienen con la salud la hipertrofia e hiperplasia de los adipocitos?
Pues grande. Cuando se produce una hipertrofia de los adipocitos, los adipocitos van creciendo de tamaño hasta llegar a tocarse. En esta situación, la difusión del oxígeno también está obstruida y los adipocitos sufren un estado de hipoxia [5]. Por otro lado, a estos adivenitos en los que se encuentran hipertrofiados se añaden también los macrófagos inflamatorios. Así, el tejido adiposo segrega citoquinas inflamatorias a la sangre, como las interleucinas 6 y 8 (IL-6 e IL-8), la proteína 1 monocitaria (MCP1) y el factor de necrosis tumoral (TNF) [6]. Todos estos procesos darán lugar a una inflamación crónica a bajo nivel que provocará alteraciones en el funcionamiento normal de los adipocitos (Figura 1). Por un lado, se intensifica la lipólisis en estado basal de los adipocitos (movilización de grasas de reserva) y se liberan más ácidos grasos libres a la sangre. Estos ácidos grasos libres se acumularán en órganos y tejidos distintos del tejido adiposo, en forma de triglicéridos, principalmente en hígado y músculos, produciendo lo que se denomina lipotoxicidad. Algunos estudios han demostrado que los mayores niveles de ácidos grasos libres se asocian al desarrollo de la resistencia a la insulina y el esteatosis hepática (acumulación excesiva de grasa en el hígado) [7]. Por otra parte, la producción de agentes inflamatorios del citoquino anteriormente mencionado impedirá la adipogénesis. En consecuencia, la diferenciación de los adipocitos inmaduros será más limitada y se generarán menos adipocitos nuevos [8]. Todos estos hechos nos conducirán al contexto que se explica al inicio de este párrafo, entrando en un círculo vicioso, aparentemente sin solución.
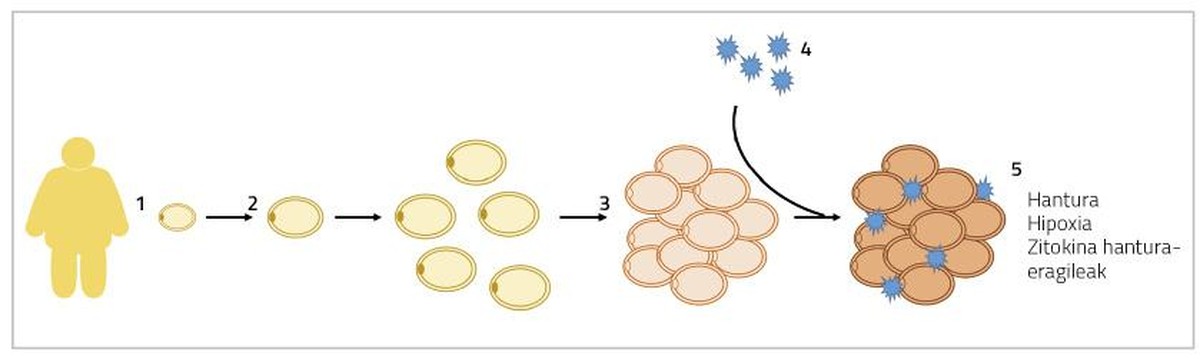
En caso de hiperplasia de los adipocitos, los excedentes energéticos se acumularán en nuevos adivenitos, disminuyendo la presencia de adivenitos hipertrofiados. En consecuencia, el flujo de citoquinas inflamatorias también disminuirá [5]. Por otra parte, se ha relacionado la formación de adipocitos de menor tamaño con la angiogénesis (formación de nuevos vasos sanguíneos), que evitará la hipoxia de los adipocitos y la inflamación del tejido adiposo asociado [9]. En este sentido, se ha observado que los ratones afectados genéticamente por la adipogénesis indefinida del porcentaje de grasa son metabolicamente sanos cuando se alimentan de dietas de engorde. En los seres humanos se ha encontrado algo parecido.
De hecho, los porcentajes adipocitos de grasa en personas con síndrome metabólico presentan una infiltración de hipertrofia, hipoxia y macrófagos; y, por otro lado, en el tejido adiposo de personas obesas y metabolicamente sanas, se han descrito adipocitos de menor tamaño y mayor número de vasos sanguíneos (Figura 2) [2]. Por lo tanto, una solución al problema puede ser provocar la adipogénesis en las personas obesas. De este modo, estas personas desarrollarían menores adipocitos y, en consecuencia, tendrían menor riesgo de padecer enfermedades metabólicas.
Desgraciadamente, no es tan simple. De hecho, según el tejido graso, los adipocitos que se pueden encontrar en él son diferentes. Por ejemplo, el tejido graso visceral aumenta por hipertrofia, mientras que el tejido adiposo subcutáneo tiende a hiperplasia. Además, la capacidad de los depósitos de grasa para la adipogénesis difiere de los estímulos que lo inducen [2]. En los estudios realizados con los roedores se ha observado que la activación de la adipogénesis genéticamente inducida provoca el desarrollo de adipocitos de menor tamaño en las cepas transgénicas (sin influir en el contenido de grasa corporal ni en el peso) y que se convierten en metabolicamente más sanos [7]. En el caso de los seres humanos, a pesar de no haber realizado este tipo de trabajo, se ha descrito algo parecido con el medicamento tiazolidinediona (DGT) utilizado para el tratamiento de la diabetes tipo 2. Esto se debe a que, además de mejorar la diabetes, produce un aumento del tejido adiposo, una disminución del tamaño de los adipocitos locales y una disminución del flujo de agentes inflamatorios de la citoquina. A diferencia de los animales, la mejora metabólica que producen estos fármacos coincide con el aumento del peso corporal [10]. Sin embargo, todavía queda por ver si es posible producir la adipogénesis en humanos adultos sin efectos nocivos sobre el peso corporal u otros procesos metabólicos. En este contexto hay que destacar que muchos estudios realizados hasta la fecha en torno a la adipogénesis se han dirigido a inhibir la propia adipogénesis. De hecho, al probar moléculas y compuestos que pueden ser adecuados para tratar la obesidad, se estudia su capacidad para inhibir la adipogénesis. Y la verdad es que eso tiene su sentido: si se producen menos adivenitos, se dificultará la difusión del tejido graso (y por tanto la obesidad).
Como se puede observar, todavía queda mucho camino por recorrer para lograr un tratamiento farmacológico efectivo de la obesidad. A pesar de que el concepto de obeso es aparentemente atractivo (y razonable), metabolicamente sano, no existe un consenso absoluto entre los investigadores sobre las consecuencias para la salud de esta situación. Comprender bien el desarrollo de tejidos grasos anatómicamente diferentes puede ayudar a modificar la distribución de grasa corporal o el funcionamiento del tejido adiposo en personas obesas. Sin embargo, todavía queda claro que la prevención es la intervención más eficaz contra la obesidad.
Bibliografía
Trabajo presentado a los premios CAF-Elhuyar.






