Adipòcits, obesitat i salut: relació més complexa de l'esperat
Nutrizioa eta Obesitatea ikerketa taldea (EHU) CIBEROBN eta BIOARABA Osasun Institutuak
Nutrizioa eta Obesitatea taldea, EHU. CIBERobn, Carlos III Osasun Institutua. BIOARABA Osasunaren Ikerketa Zentroa
Però comencem pel principi. L'obesitat és una malaltia crònica caracteritzada per una acumulació excessiva de greix que pot ser perjudicial per a la salut. Malgrat tractar-se d'una malaltia multifactorial, els hàbits alimentosos i els factors ambientals es consideren com a factors principals (estil de vida sedentari i ingestió energètica excessiva) [1]. El desenvolupament de l'obesitat requereix un desequilibri entre el consum i la despesa energètica, que s'allarga en el temps. Aquest excés d'energia s'acumula en les unitats funcionals del teixit adipós, adipòcits, en forma de triglicèrids, mitjançant dos mecanismes: la hipertròfia dels adipòcits (augment de grandària dels adipòcits per a acumular excedents energètics) i la hiperplàsia dels adipòcits (augment del nombre d'adipòcits). A pesar que des de fa temps es coneix el paper que exerceixen els adipòcits en l'acumulació d'energia, no hem fet més que prendre consciència de la importància que tenen aquestes cèl·lules de teixit adipós en el manteniment de l'homeòstasi metabòlica del cos [2].
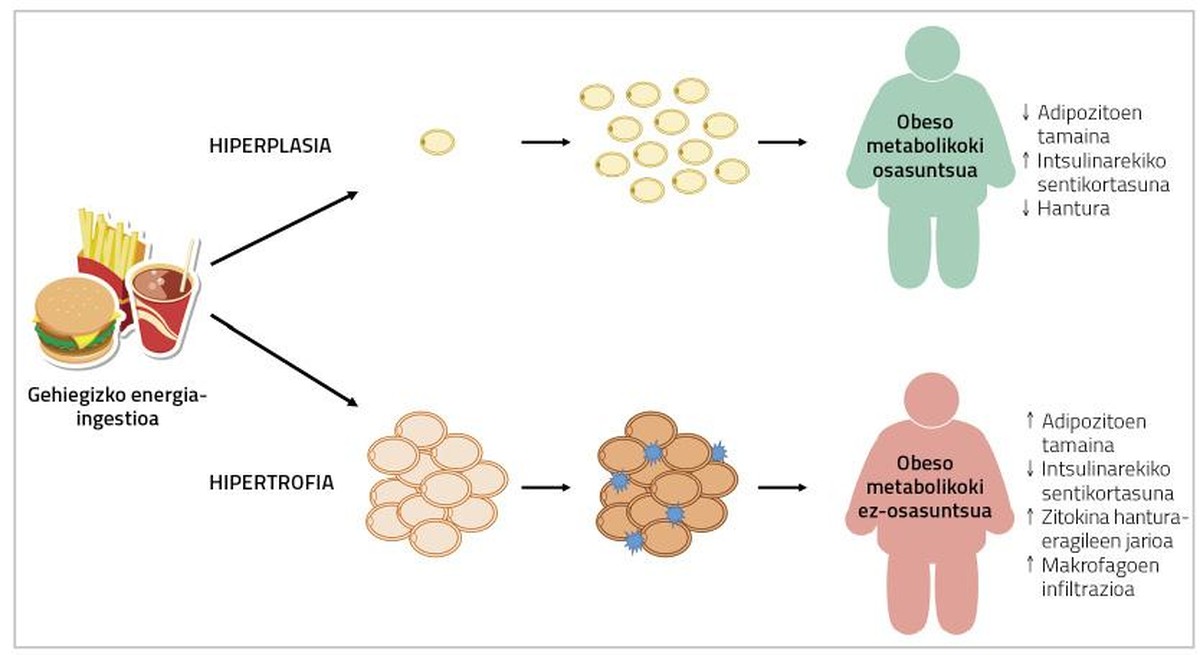
En general, la capacitat d'hipertròfia dels adipòcits es relaciona amb l'obesitat que es desenvolupa en l'edat adulta, mentre que la hiperplàsia s'ha considerat com el mecanisme impulsor de l'obesitat infantil i juvenil. De fet, fins fa poc es pensava que el nombre d'adipòcits d'un teixit gras era limitat i es mantenia constant des de la infància fins a la maduresa [3]. No obstant això, en estudis recents amb rosegadors s'ha observat que en l'edat adulta també es produeixen nous adivenitos en abusar de l'energia. Aquests nous adipòcits sorgeixen de la diferenciació dels adipòcits immadurs i participen en la difusió del teixit adipós (hiperplàsia) [4]. Però, malgrat això, quina relació tenen amb la salut la hipertròfia i hiperplàsia dels adipòcits?
Doncs gran. Quan es produeix una hipertròfia dels adipòcits, els adipòcits van creixent de grandària fins a arribar a tocar-se. En aquesta situació, la difusió de l'oxigen també està obstruïda i els adipòcits sofreixen un estat d'hipòxia [5]. D'altra banda, a aquests adivenitos en els quals es troben hipertrofiados s'afegeixen també els macròfags inflamatoris. Així, el teixit adipós segrega citocines inflamatòries a la sang, com les interleucines 6 i 8 (IL-6 i IL-8), la proteïna 1 monocitaria (MCP1) i el factor de necrosi tumoral (TNF) [6]. Tots aquests processos donaran lloc a una inflamació crònica a baix nivell que provocarà alteracions en el funcionament normal dels adipòcits (Figura 1). D'una banda, s'intensifica la lipólisis en estat basal dels adipòcits (mobilització de greixos de reserva) i s'alliberen més àcids grassos lliures a la sang. Aquests àcids grassos lliures s'acumularan en òrgans i teixits diferents del teixit adipós, en forma de triglicèrids, principalment en fetge i músculs, produint el que es denomina lipotoxicidad. Alguns estudis han demostrat que els majors nivells d'àcids grassos lliures s'associen al desenvolupament de la resistència a la insulina i l'esteatosis hepàtica (acumulació excessiva de greix en el fetge) [7]. D'altra banda, la producció d'agents inflamatoris del citoquino anteriorment esmentat impedirà l'adipogénesis. En conseqüència, la diferenciació dels adipòcits immadurs serà més limitada i es generaran menys adipòcits nous [8]. Tots aquests fets ens conduiran al context que s'explica a l'inici d'aquest paràgraf, entrant en un cercle viciós, aparentment sense solució.
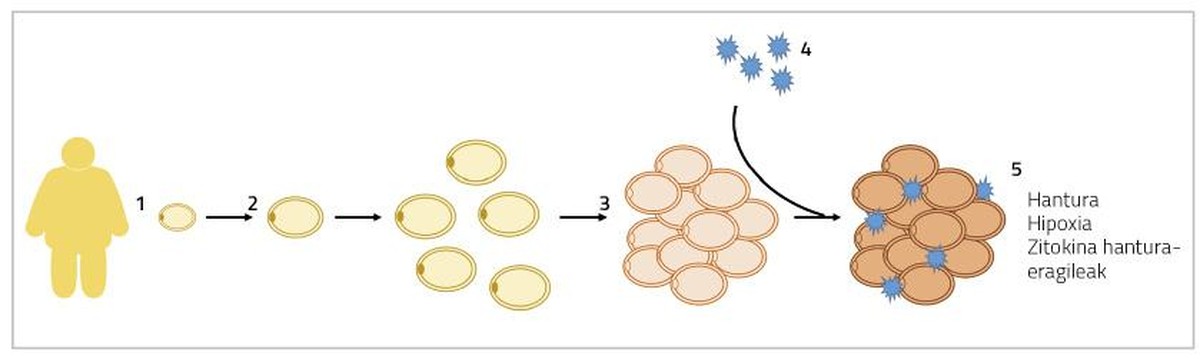
En cas d'hiperplàsia dels adipòcits, els excedents energètics s'acumularan en nous adivenitos, disminuint la presència d'adivenitos hipertrofiados. En conseqüència, el flux de citocines inflamatòries també disminuirà [5]. D'altra banda, s'ha relacionat la formació d'adipòcits de menor grandària amb l'angiogénesis (formació de nous vasos sanguinis), que evitarà la hipòxia dels adipòcits i la inflamació del teixit adipós associat [9]. En aquest sentit, s'ha observat que els ratolins afectats genèticament per l'adipogénesis indefinida del percentatge de greix són metabolicamente sans quan s'alimenten de dietes d'engreixament. En els éssers humans s'ha trobat una cosa semblant.
De fet, els percentatges adipòcits de greix en persones amb síndrome metabòlica presenten una infiltració d'hipertròfia, hipòxia i macròfags; i, d'altra banda, en el teixit adipós de persones obeses i metabolicamente sanes, s'han descrit adipòcits de menor grandària i major nombre de vasos sanguinis (Figura 2) [2]. Per tant, una solució al problema pot ser provocar l'adipogénesis en les persones obeses. D'aquesta manera, aquestes persones desenvoluparien menors adipòcits i, en conseqüència, tindrien menor risc de patir malalties metabòliques.
Desgraciadament, no és tan simple. De fet, segons el teixit gras, els adipòcits que es poden trobar en ell són diferents. Per exemple, el teixit gras visceral augmenta per hipertròfia, mentre que el teixit adipós subcutani tendeix a hiperplàsia. A més, la capacitat dels dipòsits de greix per a l'adipogénesis difereix dels estímuls que ho indueixen [2]. En els estudis realitzats amb els rosegadors s'ha observat que l'activació de l'adipogénesis genèticament induïda provoca el desenvolupament d'adipòcits de menor grandària en els ceps transgènics (sense influir en el contingut de greix corporal ni en el pes) i que es converteixen en metabolicamente més sans [7]. En el cas dels éssers humans, malgrat no haver realitzat aquest tipus de treball, s'ha descrit alguna cosa semblança amb el medicament tiazolidinediona (DGT) utilitzat per al tractament de la diabetis tipus 2. Això es deu al fet que, a més de millorar la diabetis, produeix un augment del teixit adipós, una disminució de la grandària dels adipòcits locals i una disminució del flux d'agents inflamatoris de la citocina. A diferència dels animals, la millora metabòlica que produeixen aquests fàrmacs coincideix amb l'augment del pes corporal [10]. No obstant això, encara queda per veure si és possible produir l'adipogénesis en humans adults sense efectes nocius sobre el pes corporal o altres processos metabòlics. En aquest context cal destacar que molts estudis realitzats fins avui entorn de l'adipogénesis s'han dirigit a inhibir la pròpia adipogénesis. De fet, en provar molècules i compostos que poden ser adequats per a tractar l'obesitat, s'estudia la seva capacitat per a inhibir l'adipogénesis. I la veritat és que això té el seu sentit: si es produeixen menys adivenitos, es dificultarà la difusió del teixit gras (i per tant l'obesitat).
Com es pot observar, encara queda molt camí per recórrer per a aconseguir un tractament farmacològic efectiu de l'obesitat. A pesar que el concepte d'obès és aparentment atractiu (i raonable), metabolicamente sa, no existeix un consens absolut entre els investigadors sobre les conseqüències per a la salut d'aquesta situació. Comprendre bé el desenvolupament de teixits grassos anatòmicament diferents pot ajudar a modificar la distribució de greix corporal o el funcionament del teixit adipós en persones obeses. No obstant això, encara queda clar que la prevenció és la intervenció més eficaç contra l'obesitat.
Bibliografia
Treball presentat als premis CAF-Elhuyar.






