Chirurgie contre la maladie de Parkinson
Le tableau clinique de la maladie a été décrit par le médecin James Parkinson en 1817. Bien qu'à l'époque on le connût comme paralysie agitans, des années plus tard le neurologue français Charcot proposa le nom de maladie de Parkinson, tel que nous le connaissons depuis.
Depuis que le cadre clinique est connu, on a souvent essayé de traiter médicalement par chirurgie. Cependant, les séances d'opération ont été considérablement réduites à partir de 1968, année où la lévodopa, le médicament le plus efficace contre la maladie, est devenue accessible. Depuis lors, seuls les malades les plus graves fonctionnent.
Concepts de base
Que se passe-t-il dans le cerveau du patient ? La maladie de Parkinson est due, en définitive, à la perte de certaines cellules dans la zone intermédiaire entre le cerveau et la moelle épinière, cellules dopaminergiques présentes dans la substance noire du mésencéphale. Ces cellules sont perdus peu à peu, mais on ne sait pas pourquoi. Ce processus implique des facteurs génétiques, environnementaux, infectieux, etc.
Cependant, les conclusions ont été bien analysées. Dans la partie du cerveau qui contrôle les mouvements quotidiens, les ganglions basaux réduisent la quantité de dopamine. La dopamine est un neurotransmetteur, une molécule que les neurones utilisent pour communiquer entre eux. Par conséquent, la diminution de la dopamine dans les ganglions basaux rend le mouvement incontrôlable et affleure les symptômes connus de la maladie de Parkinson.

Pour commencer à remarquer les symptômes, le patient a perdu 80% des cellules de la substance noire. Au début, il perd la dextérité dans sa main et commence à remarquer la vibration et les douleurs du bras. Dès lors, les symptômes ne cessent de croître. La rigidité du tronc, l'amortissement des mouvements propres, la vibration et la marche à pied deviennent de plus en plus difficiles. Des troubles psychiatriques, des hallucinations et des démences apparaissent également dans les dernières étapes.
Une des options est la chirurgie

Les médicaments peuvent être une grande aide dans ce processus de dégénérescence. Cependant, au fil du temps, ils peuvent perdre de l'efficacité et être préjudiciables. Parmi elles, la dyskinèse (mouvements incontrôlables sans rythme), la fluctuation des symptômes tout au long de la journée et les troubles psychiatriques.
Actuellement, la chirurgie ne s'applique qu'aux patients très malades. En outre, tous les patients ne peuvent pas être intervenus. Il existe de nombreuses limites, y compris l'âge du patient. En outre, il faut savoir si vous souffrez d'une autre maladie grave et si les fonctions supérieures ou cognitives sont complètes pour décider si elle fonctionne ou non. Et surtout, il faut analyser dans chaque cas le degré d'amélioration que suppose l'intervention, pour lequel on utilise des tests spéciaux.
Le but de la chirurgie est de contrôler l'activité excessive du subtalamo. Cette activité est une conséquence de la décompensation des circuits entre neurones, donc en quoi consiste la chirurgie? Le noyau subtalamique est un noyau subtalamique qui est stimulé par des lésions ou par une fréquence élevée par des médicaments ou la température. Ces stimuli soulagent les symptômes de la maladie de Parkinson. L'intervention consiste à placer le patient une électrode qui émet le stimulus constamment au cerveau.
Pour la première fois, les scientifiques ont vu cet effet sur les rats et les singes. Plus tard, en 1993, un groupe français a appliqué le même traitement chez les humains. Depuis, cette chirurgie a été utilisée pour traiter la maladie et est devenue une pratique courante. Mais comment décidez-vous quand, comment et dans quels cas ?

Il ne fait aucun doute que la chirurgie a de grands avantages et pourtant vous devez tenir compte des inconvénients. En fait, l'intervention soulage les symptômes de la maladie et réduit considérablement la quantité de médicament à ingérer. De plus, si la stimulation causait plus de mal que de profit, par l'union du courant disparaîtrait l'effet nuisible.
Et si l'intervention améliore le patient, jusqu'à quand durera l'amélioration ? La vérité est que, avec la méthode opérationnelle si récente, il n'est pas encore clair jusqu'à quand l'amélioration des symptômes induits chirurgicalement sera maintenue. Dans la littérature médicale, les équipes les plus expérimentées ont eu les patients sous contrôle pendant cinq ans et, en général, affirment que l'amélioration continue. Cependant, comme dans de nombreux autres domaines, le traitement définitif sera une greffe cellulaire ou un traitement génétique. Avec ces traitements, le cerveau pourrait produire de la dopamine sur place.
Opération
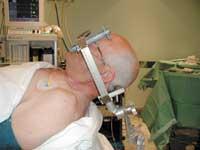
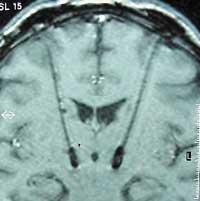
Le patient est soumis à de nombreuses recherches et analyses pour déterminer s'il est prêt pour l'intervention. Cependant, la décision d'opérer ne signifie pas que les tests ont pris fin. Le médecin doit connaître l'emplacement exact du sous-talamo pour réaliser la moindre incision possible. Pour cela, deux séances sont organisées: d'abord, trois ou quatre jours avant l'intervention, l'IRM du cerveau est effectuée; enfin, le jour même de l'intervention, le cadre stéréo est fixé et le scanner cérébral est effectué. Les deux sessions donnent une image du cerveau du patient et sont réunis avec un logiciel complexe. Cette 'fusion' d'images permet de localiser exactement le sous-talamo en coordonnées cartésiennes.
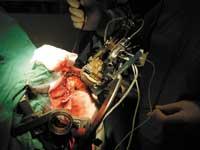
Mais le travail de recherche n'est pas terminé, il faut encore déterminer le groupe neuronal dans lequel il faut agir, à savoir mesurer l'activité des neurones, pour ce qui est exploré avec une électrode attachée à un oscilloscope. Une fois identifiés les neurones appropriés, la même électrode est utilisée pour provoquer la microstimulation. Dans cette phase, il est impératif que le patient reste aussi rapide et éveillé que possible, car ce sera lui qui fournira au médecin les informations nécessaires, car en principe et en fonction de ce que le patient ressent à la suite de l'exécution des ordres donnés, le médecin peut savoir si la stimulation produit ou non un dommage. En l'absence de problèmes, l'électrode de stimulation définitive remplace le précédent.
Le suivi ultérieur nécessite une résonance magnétique supplémentaire à vingt-quatre heures. Cette résonance est effectuée pour détecter d'éventuels problèmes, c'est-à-dire si l'électrode a été déplacée, si un caillot a été produit, etc. Enfin, si tout s'est bien passé, une nouvelle opération est réalisée pour introduire une batterie qui fournit du courant électrique à l'électrode. La batterie est placée sous la clavicule, sous la membrane. Une fois fixée la fréquence du courant, la puissance et la durée du pouls, le processus est terminé.





