Os xenomas dos culpables da malaria á vista

Toda esta información utilizarase paira revelar os segredos mellor gardados da enfermidade. O obxectivo final é atopar novas estratexias paira loitar contra a malaria. Hai que ter en conta que se trata dunha enfermidade mortal. Segundo datos da Organización Mundial da Saúde, cada ano 300 millóns de persoas enferman gravemente e morren polo menos un millón por culpa da malaria. O 90% das mortes prodúcense en África Subsahariana e cada 30 segundos un neno enferma por malaria.
Os primeiros síntomas da malaria aparecen entre 9 e 14 días despois da picadura dos mosquitos, e son similares aos da gripe: febre, dor de cabeza, náuseas... Se a enfermidade avanza, aparece una anemia e se obstruyen os vasos sanguíneos que van ao cerebro e a outros órganos principais. Como consecuencia diso, estes órganos non reciben sangue e, finalmente, poden morrer.
Parásito e mosquito

A malaria é coñecida desde hai moito tempo, pero até hai pouco máis dun século non sabían que é o que provoca a enfermidade. Antigamente considerábase que a orixe da enfermidade era o dos pantanos enrolados, de aí o seu nome (‘mal aria’ ou mal aire). En 1880, os científicos descubriron o verdadeiro culpable da malaria: o Plasmodium parásito unicelular que infecta o fígado humano e os glóbulos vermellos. Máis tarde descubriuse que o parásito transmítese dunha persoa a outra mediante a punción da mosquita femia do xénero Anopheles.
En humanos, a malaria está causada por catro especies do Plasmodium: P. malariae, P. vivax, P. ovale e P. falciparum . Este último é o responsable do tipo de malaria máis grave. En todos eles, o vector é o mosquito Anopheles, por medio do cal é imprescindible pasar o parásito para que o ciclo avance e o parásito convértase nun contaminante do ser humano. De feito, o Plasmodium ten un ciclo complexo e non todas as etapas coñecéronse até 1948.
Xenoma do parásito Plasmodium falciparum

Agora deuse un paso máis: dentro dun ambicioso proxecto de investigación de malaria, tres grupos de bioquímicos desenvolveron un proxecto de descodificación do xenoma do microorganismo P. falciparum. Un equipo pertence ao laboratorio inglés Sanger Centre (Cambridge) e ha decodificado nove cromosomas. O resto dos cromosomas foron descodificados por dous grupos de Estados Unidos, do Instituto TBAJO (Maryland) e da Universidade de Stanford (California).
Paralelamente, hase descodificado o xenoma doutro microorganismo similar, o Plasmodiun yoelii yoelii, responsable da malaria nas ratas; comparados ambos, os científicos saberán que converte un microorganismo en nocivo paira o home e o outro non.
Os científicos pasaron moito tempo descodificando o xenoma do P. falciparum, o que é moi significativo. Pode pensarse que descodificar completamente o xenoma de calquera organismo é e é así, pero debido ao seu tamaño tardaron demasiado tempo.
O ADN do P. falciparum está formado por 23 millóns de pares de bases, divididos en 14 cromosomas. Os datos non son máis que números, aínda que, por exemplo, o xenoma da mosca Drosophila melanogaster, con 120 millóns de pares de bases, foi descodificado en menos dun ano. Con todo, o proxecto de xenoma deste microorganismo púxose en marcha en 1996, e é una consecuencia evidente das dificultades que se atoparon para que se requira un prazo tan longo.

A orixe destas dificultades radica nos compoñentes do xenoma, en realidade a metodoloxía que foi exitosa con outros xenomas non é apropiada paira o estudo do Plasmodium falciparum. De feito, as bases que utiliza o ADN son catro, G, C, T e A, pero este microorganismo ten unhas secuencias moi longas compostas unicamente por bases A e T. Paira descodificar o xenoma rompe o ADN en pequenas partes, se descodifica cada anaco e ordénase informáticamente paira buscar a secuencia orixinal. Este último paso complícase cando en lugar de catro bases só participan dúas.
Nas estruturas cromosómicas deste microorganismo atopáronse tamén una serie de peculiares características. Por exemplo, a estrutura dos telómeros extremos é moi complexa, o que, segundo os científicos, facilita o paso de mutacións, moitas delas prodúcense nesas zonas do xenoma. Por tanto, os Plasmodium son microorganismos bastante variables, o que impide avanzar na investigación da malaria.
O misterio dos metabolitos
Ademais das dificultades de descodificación, estas secuencias xeran problemas de interpretación. Nós sabemos que este tipo de secuencias non codifican xénero, pero talvez sexa necesario reformulalas.
Durante a investigación utilizouse software que detecta onde se atopan os xenes (con intrón), pero estes programas non son exactos e os seus criterios paira identificar un xene son insuficientes ou correctos. No caso do xenoma humano tamén existía o mesmo problema, xa que aínda non é posible dicir cantos xenes ten o ser humano.
A estratexia que se utiliza na actualidade é a comparativa con xenes coñecidos. Paira iso utilízanse xenes doutros organismos similares. Por suposto, isto non é un éxito, xa que se atopa coas características xenéticas propias de cada especie. O xenoma do Plasmodium falciparum, ademais, provocou grandes sorpresas. Por exemplo, as proteínas típicas que "xestionan" as moléculas básicas que transportan enerxía non foron expostas nestes estudos, nin do ATP nin da NADH.

Ademais, atopáronse poucas proteínas de transporte. Con todo, os investigadores detectaron polo menos una sinal da actividade mitocondrial e identificaron moitos xenes relacionados cos apicoplastos (zonas de sínteses de ácidos grasos).
Que significa todo isto? Estamos ante un novo tipo de metabolismo? Ou a metodoloxía paira atopar proteínas aínda é moi atrasada?
O xenoma do mosquito tamén descodificado
Aínda que P. falciparum é o principal culpable da malaria, paira contaxiar aos seres humanos é imprescindible a participación da mosquita femia Anopheles, xa que o parásito ocupa no seu interior una das etapas do seu ciclo.
Na descodificación do xenoma do mosquito participaron numerosos investigadores internacionais. Liderados por Robert A, de Celera Genomics. Foi Holt, e entre todos conseguiron analizar o xenoma do mosquito Anopheles gambiae. Paira iso utilizouse o método shotgun, é dicir, hanse secuenciado aleatoriamente varias partes do xenoma e uníronse os extremos que se solapan. Finalmente obtívose un xenoma de 278 millóns de nucleótidos, unidades básicas do ADN.
Cando a mosquita femia toma o sangue humano, algunhas proteínas e lípidos do sangue van aos ovarios e axudan a desenvolver os ovos en 2-3 días. Tras porlle os ovos, volve buscar a un hóspede paira coller o seu sangue, facer a dixestión e desenvolver e pór os ovos.
Os compoñentes que se forman ao dixerir o sangue fan que algúns xenes se activen e outros se inactiven. Paira pescudar cales son estes xenes, analizáronse as partes do ADN que codifican os xenes, tanto nas mosquitas femias que colleron sangue como nas que non adquiriron sangue, e comparáronse os resultados.
Outros investigadores centráronse nas partes móbiles do xenoma. Estas partes denomínanse transposon e teñen a capacidade de situarse no xenoma en calquera lugar. Así, ás veces están fóra e outras dentro, e poden aparecer en calquera lugar. Como consecuencia, loxicamente, a variabilidade aumenta enormemente. Pois ben, este tipo de fragmentos supoñen o 16% do xenoma do mosquito. Ademais, identificáronse os xenes que codifican a encima que divide o ADN.
Despois de todo isto, que?
Agora esa é a pregunta principal. Sen dúbida, fíxose un traballo tremendo, pero despois haberá que saber como interpretar e utilizar a información. O coñecemento dos xenes permite identificar os destinos dos novos medicamentos e aí xurdiron moitas posibilidades.

Por exemplo, aínda que non conseguiron comprender o metabolismo do parásito P. falciparum, é posible que poida deseñar novas estratexias contra el. De feito, identificáronse cinco proteínas que participan en vacuolas de alimentación que poderían ser bloqueadas mediante inhibidores específicos.
Outra vía sería impedir que o parásito entre nos glóbulos vermellos. As proteínas presentes na superficie do parásito axúdanlle a escapar, polo que se se coñecen estas proteínas poderanse deseñar novos fármacos.
En canto ao xenoma do mosquito, os investigadores consideraron que hai máis dun foco de insecticidas ou vacinas. Ademais, consideran que as partes móbiles do ADN pódense utilizar paira introducir novos xenes no xenoma do mosquito, por exemplo, paira introducir no interior do mosquito algún xene que rompa o ciclo do parásito. Estes últimos tamén poden ser utilizados como marcadores paira diferenciar as poboacións de mosquitos da mesma especie, xa que algunhas poboacións son mellores transmisores de malaria ou máis resistentes aos insecticidas.
Tamén analizaron como o mosquito aborda ao home. Ao parecer, o mosquito ten a capacidade de recoñecer o cheiro do ser humano, e con iso elixe a quen chegar. Agora identificáronse os receptores do cheiro de A. gambiae; paira evitar a picadura do mosquito bastaría con bloquealos.
Ademais, varios científicos propoñen transformar xeneticamente o mosquito paira convertelo en incapaz de transmitir a enfermidade. Xa se conseguiron estes mosquitos e algúns propoñen a súa solta na natureza para que substitúan ás poboacións de mosquitos comúns. Antes, con todo, é necesario profundar na ecoloxía do mosquito, sobre a que actuou un dos grupos de investigadores do proxecto. Outros trataron o aspecto inmunológico, etc.
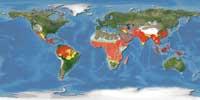
En calquera caso, porque se cre que a metade é corrupta e aínda hai moito traballo por facer, é mellor ser prudente. Segundo os propios investigadores, no transcurso do seu traballo, tiñan una dúbida: cal é a mellor maneira de combater a malaria? Proxectos xenéticos de alto nivel? Programas convencionais de vixilancia da saúde pública? A solución pode ser utilizar ambas as vías. Non hai que esquecer o XX. Até mediados do século XX a malaria estaba moito máis estendida que na actualidade e era habitual en moitos países de clima tépedo, mesmo en Euskal Herria.
A instalación de servizos hixiénicos básicos e sumidoiros nalgunhas zonas permitiu controlar a malaria ao eliminar as zonas de reprodución de mosquitos. En moitos países, con todo, aínda non contan con este tipo de avances; ademais, teñen una temperatura e humidade entre 20-30ºC, é dicir, un clima ideal paira a reprodución do mosquito. A ver se as novas opcións que se abren danlles solución.
Ciclo da malaria
Cando a femia Eltxo aborda a unha persoa, introduce as formas iniciais da súa parásito Plasmodium, os esporozoitos. Os esporozoitos escápanse do sistema inmune e chegan ao fígado a través da circulación sanguínea. Alí, cada esporozoito crea una estrutura especial denominada esquizonte, cada un dos cales achega miles de merozoitos. Así, durante 12 días, una célula hepática pode conter miles de merozoitos ou parásitos mozos. Cando chega o esquizonte, os merozoitos libéranse ao sangue e entran rapidamente nos glóbulos vermellos.
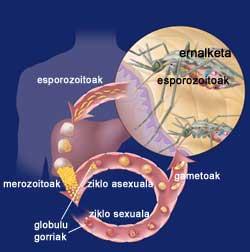
Dentro dos glóbulos vermellos, os parásitos crecen de dúas maneiras, xa que poden ter un ciclo sexual asexual. No ciclo sexual fórmanse gametocitos femias e machos. Estes mórrense no sangue e cando chegan una mosquita femia reúnense no estómago do mosquito. Na parede do estómago fórmanse oocistos que tras uns días dan lugar a un gran número de esporozoitos. Os esporozoitos recóllense na glándula salival do mosquito e están preparados paira introducirse no interior do hóspede a través da seguinte punción.
Doutra banda, no ciclo asexual, os parásitos desenvólvense nos glóbulos vermellos. Paira o seu desenvolvemento utilizan a hemoglobina dos glóbulos vermellos, encargada do transporte de osíxeno no sangue. Do mesmo xeito que nas células do fígado ao principio, no seu interior fórmanse uns esquizontes ricos en merozoitos que, cando maduran, explotan e devolven ao sangue. De paso, os glóbulos vermellos quedan destruídos. E moito máis destruiranse mentres non se controle a enfermidade, xa que os merozoitos recentemente liberados contaminarán outros glóbulos vermellos.
Loita estéril contra a malaria
Probáronse moitos medicamentos contra a malaria. Antigamente utilizouse moito a quinina, produto natural que se obtiña da cortiza de quinina. Pero ao ser moi tóxico descartouse. Cando se descubriu o cloroquín deuse un gran paso adiante polo seu baixo custo e eficacia. Con todo, as catro especies de Plasmodium que provocan malaria no ser humano desenvolveron resistencia e agora os investigadores buscan un medicamento que substitúa ao cloroquín. Ao descodificar o xenoma do parásito descobren como o parásito conseguiu esta resistencia e a doutros fármacos.

Paira acabar co mosquito utilizáronse diferentes estratexias, sobre todo insecticidas. Entre eles utilizouse un contaminante DDT perigoso. O mosquito, con todo, foi capaz de resistir a todos.
Crese que a resistencia aos insecticidas maniféstase mediante dous mecanismos: o aumento da expresión dos xenes que desintoxican ao insecticida ou a mutación dos xenes que codifican as proteínas obxectivo dos insecticidas. No xenoma detectáronse dous tipos de xenes, así como variantes denominadas SNP nos nucleótidos individuais. En opinión de Holt, esta información pode servir paira identificar metas paira elaborar novos insecticidas.
Tamén se abordaron outras vías baseadas na interrupción do ciclo do parásito no corpo do hóspede ou na promoción do sistema inmune. Moita xente tamén ten moitas expectativas na vacina do investigador Patarroyo. Con todo, aínda non hai solución total paira combater a malaria. De aí o interese por coñecer os códigos xenéticos do mosquito Anopheles e o parásito Plasmodium.