Los genomas de los culpables de la malaria a la vista

Toda esta información se utilizará para revelar los secretos mejor guardados de la enfermedad. El objetivo final es encontrar nuevas estrategias para luchar contra la malaria. Hay que tener en cuenta que se trata de una enfermedad mortal. Según datos de la Organización Mundial de la Salud, cada año 300 millones de personas enferman gravemente y mueren al menos un millón por culpa de la malaria. El 90% de las muertes se producen en África Subsahariana y cada 30 segundos un niño enferma por malaria.
Los primeros síntomas de la malaria aparecen entre 9 y 14 días después de la picadura de los mosquitos, y son similares a los de la gripe: fiebre, dolor de cabeza, náuseas... Si la enfermedad avanza, aparece una anemia y se obstruyen los vasos sanguíneos que van al cerebro y a otros órganos principales. Como consecuencia de ello, estos órganos no reciben sangre y, finalmente, pueden morir.
Parásito y mosquito

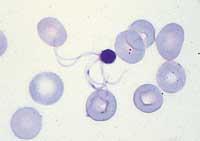
La malaria es conocida desde hace mucho tiempo, pero hasta hace poco más de un siglo no sabían qué es lo que provoca la enfermedad. Antiguamente se consideraba que el origen de la enfermedad era el de los pantanos enrollados, de ahí su nombre (‘mal aria’ o mal aire). En 1880, los científicos descubrieron el verdadero culpable de la malaria: el Plasmodium parásito unicelular que infecta el hígado humano y los glóbulos rojos. Más tarde se descubrió que el parásito se transmite de una persona a otra mediante la punción de la mosquita hembra del género Anopheles.
En humanos, la malaria está causada por cuatro especies del Plasmodium: P. malariae, P. vivax, P. ovale y P. falciparum . Este último es el responsable del tipo de malaria más grave. En todos ellos, el vector es el mosquito Anopheles, por medio del cual es imprescindible pasar el parásito para que el ciclo avance y el parásito se convierta en un contaminante del ser humano. De hecho, el Plasmodium tiene un ciclo complejo y no todas las etapas se conocieron hasta 1948.
Genoma del parásito Plasmodium falciparum

Ahora se ha dado un paso más: dentro de un ambicioso proyecto de investigación de malaria, tres grupos de bioquímicos han desarrollado un proyecto de descodificación del genoma del microorganismo P. falciparum. Un equipo pertenece al laboratorio inglés Sanger Centre (Cambridge) y ha decodificado nueve cromosomas. El resto de los cromosomas han sido descodificados por dos grupos de Estados Unidos, del Instituto TBAJO (Maryland) y de la Universidad de Stanford (California).
Paralelamente, se ha descodificado el genoma de otro microorganismo similar, el Plasmodiun yoelii yoelii, responsable de la malaria en las ratas; comparados ambos, los científicos sabrán qué convierte un microorganismo en nocivo para el hombre y el otro no.
Los científicos han pasado mucho tiempo descodificando el genoma del P. falciparum, lo que es muy significativo. Puede pensarse que descodificar completamente el genoma de cualquier organismo es y es así, pero debido a su tamaño han tardado demasiado tiempo.
El ADN del P. falciparum está formado por 23 millones de pares de bases, divididos en 14 cromosomas. Los datos no son más que números, aunque, por ejemplo, el genoma de la mosca Drosophila melanogaster, con 120 millones de pares de bases, fue descodificado en menos de un año. Sin embargo, el proyecto de genoma de este microorganismo se puso en marcha en 1996, y es una consecuencia evidente de las dificultades que se han encontrado para que se requiera un plazo tan largo.

El origen de estas dificultades radica en los componentes del genoma, en realidad la metodología que ha sido exitosa con otros genomas no es apropiada para el estudio del Plasmodium falciparum. De hecho, las bases que utiliza el ADN son cuatro, G, C, T y A, pero este microorganismo tiene unas secuencias muy largas compuestas únicamente por bases A y T. Para descodificar el genoma se rompe el ADN en pequeñas partes, se descodifica cada trozo y se ordena informáticamente para buscar la secuencia original. Este último paso se complica cuando en lugar de cuatro bases sólo participan dos.
En las estructuras cromosómicas de este microorganismo se han encontrado también una serie de peculiares características. Por ejemplo, la estructura de los telómeros extremos es muy compleja, lo que, según los científicos, facilita el paso de mutaciones, muchas de ellas se producen en esas zonas del genoma. Por tanto, los Plasmodium son microorganismos bastante variables, lo que impide avanzar en la investigación de la malaria.
El misterio de los metabolitos
Además de las dificultades de descodificación, estas secuencias generan problemas de interpretación. Nosotros sabemos que este tipo de secuencias no codifican género, pero tal vez sea necesario replantearlas.
Durante la investigación se ha utilizado software que detecta dónde se encuentran los genes (con intrón), pero estos programas no son exactos y sus criterios para identificar un gen son insuficientes o correctos. En el caso del genoma humano también existía el mismo problema, ya que todavía no es posible decir cuántos genes tiene el ser humano.
La estrategia que se utiliza en la actualidad es la comparativa con genes conocidos. Para ello se utilizan genes de otros organismos similares. Por supuesto, esto no es un éxito, ya que se encuentra con las características genéticas propias de cada especie. El genoma del Plasmodium falciparum, además, ha provocado grandes sorpresas. Por ejemplo, las proteínas típicas que "gestionan" las moléculas básicas que transportan energía no han sido expuestas en estos estudios, ni de la ATP ni de la NADH.

Además, se han encontrado pocas proteínas de transporte. Sin embargo, los investigadores han detectado al menos una señal de la actividad mitocondrial y han identificado muchos genes relacionados con los apicoplastos (zonas de síntesis de ácidos grasos).
¿Qué significa todo esto? ¿Estamos ante un nuevo tipo de metabolismo? ¿O la metodología para encontrar proteínas todavía es muy retrasada?
El genoma del mosquito también descodificado
Aunque P. falciparum es el principal culpable de la malaria, para contagiar a los seres humanos es imprescindible la participación de la mosquita hembra Anopheles, ya que el parásito ocupa en su interior una de las etapas de su ciclo.
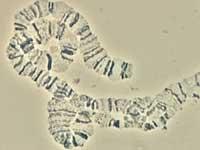
En la descodificación del genoma del mosquito han participado numerosos investigadores internacionales. Liderados por Robert A, de Celera Genomics. Ha sido Holt, y entre todos han conseguido analizar el genoma del mosquito Anopheles gambiae. Para ello se ha utilizado el método shotgun, es decir, se han secuenciado aleatoriamente varias partes del genoma y se han unido los extremos que se solapan. Finalmente se ha obtenido un genoma de 278 millones de nucleótidos, unidades básicas del ADN.
Cuando la mosquita hembra toma la sangre humana, algunas proteínas y lípidos de la sangre van a los ovarios y ayudan a desarrollar los huevos en 2-3 días. Tras ponerle los huevos, vuelve a buscar a un huésped para coger su sangre, hacer la digestión y desarrollar y poner los huevos.
Los componentes que se forman al digerir la sangre hacen que algunos genes se activen y otros se inactiven. Para averiguar cuáles son estos genes, se han analizado las partes del ADN que codifican los genes, tanto en las mosquitas hembras que cogieron sangre como en las que no adquirieron sangre, y se han comparado los resultados.
Otros investigadores se han centrado en las partes móviles del genoma. Estas partes se denominan transposon y tienen la capacidad de ubicarse en el genoma en cualquier lugar. Así, a veces están fuera y otras dentro, y pueden aparecer en cualquier lugar. Como consecuencia, lógicamente, la variabilidad aumenta enormemente. Pues bien, este tipo de fragmentos suponen el 16% del genoma del mosquito. Además, se han identificado los genes que codifican la enzima que divide el ADN.
Después de todo esto, ¿qué?
Ahora esa es la pregunta principal. Sin duda, se ha hecho un trabajo tremendo, pero después habrá que saber cómo interpretar y utilizar la información. El conocimiento de los genes permite identificar los destinos de los nuevos medicamentos y ahí han surgido muchas posibilidades.

Por ejemplo, aunque no han conseguido comprender el metabolismo del parásito P. falciparum, es posible que pueda diseñar nuevas estrategias contra él. De hecho, se han identificado cinco proteínas que participan en vacuolas de alimentación que podrían ser bloqueadas mediante inhibidores específicos.
Otra vía sería impedir que el parásito entre en los glóbulos rojos. Las proteínas presentes en la superficie del parásito le ayudan a escapar, por lo que si se conocen estas proteínas se podrán diseñar nuevos fármacos.
En cuanto al genoma del mosquito, los investigadores han considerado que hay más de un foco de insecticidas o vacunas. Además, consideran que las partes móviles del ADN se pueden utilizar para introducir nuevos genes en el genoma del mosquito, por ejemplo, para introducir en el interior del mosquito algún gen que rompa el ciclo del parásito. Estos últimos también pueden ser utilizados como marcadores para diferenciar las poblaciones de mosquitos de la misma especie, ya que algunas poblaciones son mejores transmisores de malaria o más resistentes a los insecticidas.
También han analizado cómo el mosquito aborda al hombre. Al parecer, el mosquito tiene la capacidad de reconocer el olor del ser humano, y con ello elige a quién llegar. Ahora se han identificado los receptores del olor de A. gambiae; para evitar la picadura del mosquito bastaría con bloquearlos.
Además, varios científicos proponen transformar genéticamente el mosquito para convertirlo en incapaz de transmitir la enfermedad. Ya se han conseguido estos mosquitos y algunos proponen su suelta en la naturaleza para que sustituyan a las poblaciones de mosquitos comunes. Antes, sin embargo, es necesario profundizar en la ecología del mosquito, sobre la que ha actuado uno de los grupos de investigadores del proyecto. Otros han tratado el aspecto inmunológico, etc.
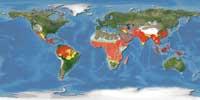
En cualquier caso, porque se cree que la mitad es corrupta y todavía hay mucho trabajo por hacer, es mejor ser prudente. Según los propios investigadores, en el transcurso de su trabajo, tenían una duda: ¿cuál es la mejor manera de combatir la malaria? ¿Proyectos genéticos de alto nivel? ¿Programas convencionales de vigilancia de la salud pública? La solución puede ser utilizar ambas vías. No hay que olvidar el XX. Hasta mediados del siglo XX la malaria estaba mucho más extendida que en la actualidad y era habitual en muchos países de clima templado, incluso en Euskal Herria.
La instalación de servicios higiénicos básicos y alcantarillas en algunas zonas ha permitido controlar la malaria al eliminar las zonas de reproducción de mosquitos. En muchos países, sin embargo, todavía no cuentan con este tipo de avances; además, tienen una temperatura y humedad entre 20-30ºC, es decir, un clima ideal para la reproducción del mosquito. A ver si las nuevas opciones que se abren les dan solución.
Ciclo de la malaria
Cuando la hembra Eltxo aborda a una persona, introduce las formas iniciales de su parásito Plasmodium, los esporozoitos. Los esporozoitos se escapan del sistema inmune y llegan al hígado a través de la circulación sanguínea. Allí, cada esporozoito crea una estructura especial denominada esquizonte, cada uno de los cuales aporta miles de merozoitos. Así, durante 12 días, una célula hepática puede contener miles de merozoitos o parásitos jóvenes. Cuando llega el esquizonte, los merozoitos se liberan a la sangre y entran rápidamente en los glóbulos rojos.
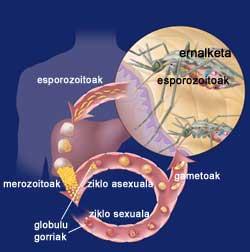
Dentro de los glóbulos rojos, los parásitos crecen de dos maneras, ya que pueden tener un ciclo sexual asexual. En el ciclo sexual se forman gametocitos hembras y machos. Estos se mueren en la sangre y cuando llegan una mosquita hembra se reúnen en el estómago del mosquito. En la pared del estómago se forman oocistos que tras unos días dan lugar a un gran número de esporozoitos. Los esporozoitos se recogen en la glándula salival del mosquito y están preparados para introducirse en el interior del huésped a través de la siguiente punción.
Por otro lado, en el ciclo asexual, los parásitos se desarrollan en los glóbulos rojos. Para su desarrollo utilizan la hemoglobina de los glóbulos rojos, encargada del transporte de oxígeno en la sangre. Al igual que en las células del hígado al principio, en su interior se forman unos esquizontes ricos en merozoitos que, cuando maduran, explotan y devuelven a la sangre. De paso, los glóbulos rojos quedan destruidos. Y mucho más se destruirán mientras no se controle la enfermedad, ya que los merozoitos recién liberados contaminarán otros glóbulos rojos.
Lucha estéril contra la malaria
Se han probado muchos medicamentos contra la malaria. Antiguamente se utilizó mucho la quinina, producto natural que se obtenía de la corteza de quinina. Pero al ser muy tóxico se descartó. Cuando se descubrió el cloroquín se dio un gran paso adelante por su bajo coste y eficacia. Sin embargo, las cuatro especies de Plasmodium que provocan malaria en el ser humano han desarrollado resistencia y ahora los investigadores buscan un medicamento que sustituya al cloroquín. Al descodificar el genoma del parásito descubren cómo el parásito ha conseguido esta resistencia y la de otros fármacos.

Para acabar con el mosquito se han utilizado diferentes estrategias, sobre todo insecticidas. Entre ellos se ha utilizado un contaminante DDT peligroso. El mosquito, sin embargo, ha sido capaz de resistir a todos.
Se cree que la resistencia a los insecticidas se manifiesta mediante dos mecanismos: el aumento de la expresión de los genes que desintoxican al insecticida o la mutación de los genes que codifican las proteínas objetivo de los insecticidas. En el genoma se han detectado dos tipos de genes, así como variantes denominadas SNP en los nucleótidos individuales. En opinión de Holt, esta información puede servir para identificar metas para elaborar nuevos insecticidas.
También se han abordado otras vías basadas en la interrupción del ciclo del parásito en el cuerpo del huésped o en la promoción del sistema inmune. Mucha gente también tiene muchas expectativas en la vacuna del investigador Patarroyo. Sin embargo, todavía no hay solución total para combatir la malaria. De ahí el interés por conocer los códigos genéticos del mosquito Anopheles y el parásito Plasmodium.