Els genomes dels culpables de la malària a la vista

Tota aquesta informació s'utilitzarà per a revelar els secrets més ben guardats de la malaltia. L'objectiu final és trobar noves estratègies per a lluitar contra la malària. Cal tenir en compte que es tracta d'una malaltia mortal. Segons dades de l'Organització Mundial de la Salut, cada any 300 milions de persones emmalalteixen greument i moren almenys un milió per culpa de la malària. El 90% de les morts es produeixen a Àfrica Subsahariana i cada 30 segons un nen malalta per malària.
Els primers símptomes de la malària apareixen entre 9 i 14 dies després de la picada dels mosquits, i són similars als de la grip: febre, mal de cap, nàusees... Si la malaltia avança, apareix una anèmia i s'obstrueixen els vasos sanguinis que van al cervell i a altres òrgans principals. Com a conseqüència d'això, aquests òrgans no reben sang i, finalment, poden morir.
Paràsit i mosquit

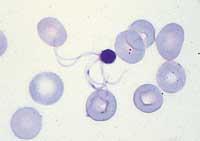
La malària és coneguda des de fa molt temps, però fins fa poc més d'un segle no sabien què és el que provoca la malaltia. Antigament es considerava que l'origen de la malaltia era el dels pantans enrotllats, d'aquí el seu nom (‘mal ària’ o mal aire). En 1880, els científics van descobrir el veritable culpable de la malària: el Plasmodium paràsit unicel·lular que infecta el fetge humà i els glòbuls vermells. Més tard es va descobrir que el paràsit es transmet d'una persona a una altra mitjançant la punció de la mosquita femella del gènere Anopheles.
En humans, la malària és causada per quatre espècies del Plasmodium: P. malariae, P. vivax, P. ovale i P. falciparum . Aquest últim és el responsable de la mena de malària més greu. En tots ells, el vector és el mosquit Anopheles, per mitjà del qual és imprescindible passar el paràsit perquè el cicle avanci i el paràsit es converteixi en un contaminant de l'ésser humà. De fet, el Plasmodium té un cicle complex i no totes les etapes es van conèixer fins a 1948.
Genoma del paràsit Plasmodium falciparum

Ara s'ha fet un pas més: dins d'un ambiciós projecte de recerca de malària, tres grups de bioquímicos han desenvolupat un projecte de descodificació del genoma del microorganisme P. falciparum. Un equip pertany al laboratori anglès Sanger Centre (Cambridge) i ha decodificado nou cromosomes. La resta dels cromosomes han estat descodificats per dos grups dels Estats Units, de l'Institut TBAJO (Maryland) i de la Universitat de Stanford (Califòrnia).
Paral·lelament, s'ha descodificat el genoma d'un altre microorganisme similar, el Plasmodiun yoelii yoelii, responsable de la malària en les rates; comparats tots dos, els científics sabran què converteix un microorganisme en nociu per a l'home i l'altre no.
Els científics han passat molt de temps descodificant el genoma del P. falciparum, la qual cosa és molt significatiu. Pot pensar-se que descodificar completament el genoma de qualsevol organisme és i és així, però a causa de la seva grandària han trigat massa temps.
L'ADN del P. falciparum està format per 23 milions de parells de bases, dividits en 14 cromosomes. Les dades no són més que números, encara que, per exemple, el genoma de la mosca Drosophila melanogaster, amb 120 milions de parells de bases, va ser descodificat en menys d'un any. No obstant això, el projecte de genoma d'aquest microorganisme es va posar en marxa en 1996, i és una conseqüència evident de les dificultats que s'han trobat perquè es requereixi un termini tan llarg.

L'origen d'aquestes dificultats radica en els components del genoma, en realitat la metodologia que ha estat reeixida amb altres genomes no és apropiada per a l'estudi del Plasmodium falciparum. De fet, les bases que utilitza l'ADN són quatre, G, C, T i A, però aquest microorganisme té unes seqüències molt llargues compostes únicament per bases A i T. Per a descodificar el genoma es trenca l'ADN en petites parts, es descodifica cada tros i s'ordena informàticament per a buscar la seqüència original. Aquest últim pas es complica quan en lloc de quatre bases només participen dues.
En les estructures cromosòmiques d'aquest microorganisme s'han trobat també una sèrie de peculiars característiques. Per exemple, l'estructura dels telómeros extrems és molt complexa, la qual cosa, segons els científics, facilita el pas de mutacions, moltes d'elles es produeixen en aquestes zones del genoma. Per tant, els Plasmodium són microorganismes bastant variables, la qual cosa impedeix avançar en la recerca de la malària.
El misteri dels metabòlits
A més de les dificultats de descodificació, aquestes seqüències generen problemes d'interpretació. Nosaltres sabem que aquest tipus de seqüències no codifiquen gènere, però tal vegada sigui necessari replantejar-les.
Durant la recerca s'ha utilitzat programari que detecta on es troben els gens (amb intró), però aquests programes no són exactes i els seus criteris per a identificar un gen són insuficients o correctes. En el cas del genoma humà també existia el mateix problema, ja que encara no és possible dir quants gens té l'ésser humà.
L'estratègia que s'utilitza en l'actualitat és la comparativa amb gens coneguts. Per a això s'utilitzen gens d'altres organismes similars. Per descomptat, això no és un èxit, ja que es troba amb les característiques genètiques pròpies de cada espècie. El genoma del Plasmodium falciparum, a més, ha provocat grans sorpreses. Per exemple, les proteïnes típiques que "gestionen" les molècules bàsiques que transporten energia no han estat exposades en aquests estudis, ni de l'ATP ni de la NADH.

A més, s'han trobat poques proteïnes de transport. No obstant això, els investigadors han detectat almenys un senyal de l'activitat mitocondrial i han identificat molts gens relacionats amb els apicoplastos (zones de síntesis d'àcids grassos).
Què significa tot això? Estem davant un nou tipus de metabolisme? O la metodologia per a trobar proteïnes encara és molt retardada?
El genoma del mosquit també descodificat
Encara que P. falciparum és el principal culpable de la malària, per a contagiar als éssers humans és imprescindible la participació de la mosquita femella Anopheles, ja que el paràsit ocupa en el seu interior una de les etapes del seu cicle.
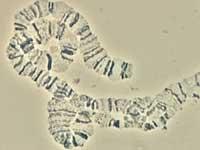
En la descodificació del genoma del mosquit han participat nombrosos investigadors internacionals. Liderats per Robert A, de Celera Genomics. Ha estat Holt, i entre tots han aconseguit analitzar el genoma del mosquit Anopheles gambiae. Per a això s'ha utilitzat el mètode shotgun, és a dir, s'han seqüenciat aleatòriament diverses parts del genoma i s'han unit els extrems que se solapen. Finalment s'ha obtingut un genoma de 278 milions de nucleòtids, unitats bàsiques de l'ADN.
Quan la mosquita femella pren la sang humana, algunes proteïnes i lípids de la sang van als ovaris i ajuden a desenvolupar els ous en 2-3 dies. Després de posar-li els ous, torna a buscar a un hoste per a agafar la seva sang, fer la digestió i desenvolupar i posar els ous.
Els components que es formen en digerir la sang fan que alguns gens s'activin i uns altres s'inactivin. Per a esbrinar quins són aquests gens, s'han analitzat les parts de l'ADN que codifiquen els gens, tant en les mosquitas femelles que van agafar sang com en les que no van adquirir sang, i s'han comparat els resultats.
Altres investigadors s'han centrat en les parts mòbils del genoma. Aquestes parts es denominen transposon i tenen la capacitat de situar-se en el genoma en qualsevol lloc. Així, a vegades estan fora i unes altres dins, i poden aparèixer en qualsevol lloc. Com a conseqüència, lògicament, la variabilitat augmenta enormement. Doncs bé, aquest tipus de fragments suposen el 16% del genoma del mosquit. A més, s'han identificat els gens que codifiquen l'enzim que divideix l'ADN.
Després de tot això, què?
Ara aquesta és la pregunta principal. Sens dubte, s'ha fet un treball tremend, però després caldrà saber com interpretar i utilitzar la informació. El coneixement dels gens permet identificar les destinacions dels nous medicaments i aquí han sorgit moltes possibilitats.

Per exemple, encara que no han aconseguit comprendre el metabolisme del paràsit P. falciparum, és possible que pugui dissenyar noves estratègies contra ell. De fet, s'han identificat cinc proteïnes que participen en vacúols d'alimentació que podrien ser bloquejades mitjançant inhibidors específics.
Una altra via seria impedir que el paràsit entri en els glòbuls vermells. Les proteïnes presents en la superfície del paràsit l'ajuden a escapar, per la qual cosa si es coneixen aquestes proteïnes es podran dissenyar nous fàrmacs.
Quant al genoma del mosquit, els investigadors han considerat que hi ha més d'un focus d'insecticides o vacunes. A més, consideren que les parts mòbils de l'ADN es poden utilitzar per a introduir nous gens en el genoma del mosquit, per exemple, per a introduir a l'interior del mosquit algun gen que trenqui el cicle del paràsit. Aquests últims també poden ser utilitzats com a marcadors per a diferenciar les poblacions de mosquits de la mateixa espècie, ja que algunes poblacions són millors transmissors de malària o més resistents als insecticides.
També han analitzat com el mosquit aborda a l'home. Pel que sembla, el mosquit té la capacitat de reconèixer l'olor de l'ésser humà, i amb això tria a qui arribar. Ara s'han identificat els receptors de l'olor de A. gambiae; per a evitar la picada del mosquit bastaria amb bloquejar-los.
A més, diversos científics proposen transformar genèticament el mosquit per a convertir-lo en incapaç de transmetre la malaltia. Ja s'han aconseguit aquests mosquits i alguns proposen la seva solta en la naturalesa perquè substitueixin a les poblacions de mosquits comuns. Abans, no obstant això, és necessari aprofundir en l'ecologia del mosquit, sobre la qual ha actuat un dels grups d'investigadors del projecte. Uns altres han tractat l'aspecte immunològic, etc.
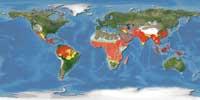
En qualsevol cas, perquè es creu que la meitat és corrupta i encara hi ha molta feina per fer, és millor ser prudent. Segons els propis investigadors, en el transcurs del seu treball, tenien un dubte: quina és la millor manera de combatre la malària? Projectes genètics d'alt nivell? Programes convencionals de vigilància de la salut pública? La solució pot ser utilitzar totes dues vies. Cal no oblidar el XX. Fins a mitjan segle XX la malària estava molt més estesa que en l'actualitat i era habitual en molts països de clima temperat, fins i tot a Euskal Herria.
La instal·lació de serveis higiènics bàsics i embornals en algunes zones ha permès controlar la malària en eliminar les zones de reproducció de mosquits. En molts països, no obstant això, encara no compten amb aquesta mena d'avanços; a més, tenen una temperatura i humitat entre 20-30 °C, és a dir, un clima ideal per a la reproducció del mosquit. A veure si les noves opcions que s'obren els donen solució.
Cicle de la malària
Quan la femella Eltxo aborda a una persona, introdueix les formes inicials del seu paràsit Plasmodium, els esporozoitos. Els esporozoitos s'escapen del sistema immune i arriben al fetge a través de la circulació sanguínia. Allí, cada esporozoito crea una estructura especial denominada esquizonte, cadascun dels quals aporta milers de merozoitos. Així, durant 12 dies, una cèl·lula hepàtica pot contenir milers de merozoitos o paràsits joves. Quan arriba l'esquizonte, els merozoitos s'alliberen a la sang i entren ràpidament en els glòbuls vermells.
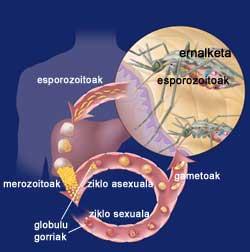
Dins dels glòbuls vermells, els paràsits creixen de dues maneres, ja que poden tenir un cicle sexual asexual. En el cicle sexual es formen gametòcits femelles i mascles. Aquests es moren en la sang i quan arriben una mosquita femella es reuneixen en l'estómac del mosquit. En la paret de l'estómac es formen oocistos que després d'uns dies donen lloc a un gran nombre d'esporozoitos. Els esporozoitos es recullen en la glàndula salival del mosquit i estan preparats per a introduir-se a l'interior de l'hoste a través de la següent punció.
D'altra banda, en el cicle asexual, els paràsits es desenvolupen en els glòbuls vermells. Per al seu desenvolupament utilitzen l'hemoglobina dels glòbuls vermells, encarregada del transport d'oxigen en la sang. Igual que en les cèl·lules del fetge al principi, en el seu interior es formen uns esquizontes rics en merozoitos que, quan maduren, exploten i retornen a la sang. De pas, els glòbuls vermells queden destruïts. I molt més es destruiran mentre no es controli la malaltia, ja que els merozoitos acabats d'alliberar contaminaran altres glòbuls vermells.
Lluita estèril contra la malària
S'han provat molts medicaments contra la malària. Antigament es va utilitzar molt la quinina, producte natural que s'obtenia de l'escorça de quinina. Però en ser molt tòxic es va descartar. Quan es va descobrir el cloroquín es va fer un gran pas endavant pel seu baix cost i eficàcia. No obstant això, les quatre espècies de Plasmodium que provoquen malària en l'ésser humà han desenvolupat resistència i ara els investigadors busquen un medicament que substitueixi al cloroquín. En descodificar el genoma del paràsit descobreixen com el paràsit ha aconseguit aquesta resistència i la d'altres fàrmacs.

Per a acabar amb el mosquit s'han utilitzat diferents estratègies, sobretot insecticides. Entre ells s'ha utilitzat un contaminant DDT perillós. El mosquit, no obstant això, ha estat capaç de resistir a tots.
Es creu que la resistència als insecticides es manifesta mitjançant dos mecanismes: l'augment de l'expressió dels gens que desintoxican a l'insecticida o la mutació dels gens que codifiquen les proteïnes objectiu dels insecticides. En el genoma s'han detectat dos tipus de gens, així com variants denominades SNP en els nucleòtids individuals. En opinió d'Holt, aquesta informació pot servir per a identificar metes per a elaborar nous insecticides.
També s'han abordat altres vies basades en la interrupció del cicle del paràsit en el cos de l'hoste o en la promoció del sistema immune. Molta gent també té moltes expectatives en la vacuna de l'investigador Patarroyo. No obstant això, encara no hi ha solució total per a combatre la malària. D'aquí l'interès per conèixer els codis genètics del mosquit Anopheles i el paràsit Plasmodium.