Coloides: que, onde e paira que
Que teñen en común os xeados, o cemento, o fume, a cervexa, o vaqueiro e as pesticidas? Estes e outros produtos químicos que utilizamos a diario son os coloides. Todos os coloides están formados por un médium homoxéneo e pequenas partículas dispersas ou dispersas nel. Outros coloides que calquera coñece son a manteiga, o sangue e o papel.
A ciencia dos coloides estuda sistemas químicos de dimensións intermedias entre micrómetros (1 m = 10 -6 m) e nanómetros (1 nm = 10 -9 m), é dicir, entidades químicas desde as partículas agregadas máis pequenas até os átomos ou moléculas máis grandes.
Aínda que, en xeral, ten moito que ver coa química e a química física, a ciencia dos coloides é una investigación interdisciplinar. A miúdo os coloides son moi complexos e os estudos que se realizan paira comprender ben as súas características non son tan precisos como os científicos desexaban. Talvez sexa un sistema complexo e que sexa ciencia de diferentes campos, durante moitos anos e aínda o é, a maioría das escolas e universidades non foron expostas.
Coloides de diferentes tipos e tamaños
W. Ostwald XX. A primeira clasificación exacta dos coloides débese ao científico gañador do premio Nobel a principios do século XX. Por primeira vez, todos os coloides establecéronse en forma de dispersión, e o científico ruso alemán decidiu clasificalos por tamaños. Considera que as dispersións se poden clasificar en tres grandes grupos: partículas e agregados maiores de 10 -7 m, como o barro; dispersións coloidales de 10 -7 -10 -9 m; e dispersións moleculares menores de 10 -9 m.
Na actualidade tamén se consideran coloides os sistemas de 2x10 -7 -5x10 -7 m. Por tanto, como se decidiu a principios do século pasado, os coloides son máis grandes que as moléculas de auga, hidróxeno ou azucre, pero máis pequenos que as células sanguíneas e as bacterias.
O premio Nobel Staundiger, en lugar de facelo por medida, tivo en conta o número de átomos dos coloides á hora de clasificalos. Staundiger cre que una partícula de coloides debería conter polo menos mil átomos. Una molécula de auga ten tres átomos e, por suposto, non é un coloide. Una molécula de azucre que dá a planta de cana ten 45 átomos, que tampouco é coloide.
O peso molecular dunha molécula orgánica de mil átomos é duns 10.000 g/mol, e se estes colocásense ao redor de una esfera formarían una partícula de 0,5-2 nm. Segundo Staundiger, por tanto, os coloides deberían ter entre 10 3 e 10 9 átomos.
EXTENSION DE DISPERSIÓN / 10 -9 mDiámetro do gran de cuarzo 50.000-20.000 mDiámetro da célula sanguínea humana7500 Diámetro da bacteria Bacilus Coli 1500Diámetro da partícula do coloide de xofre 50-500Dimensións do virus da gripe 120Diámetro da partícula do coloide de ouro 1-100 Dimensións da molécula elemental de dispersión de osíxenoColoides máis importantes: emulsiones
Como vimos ao principio, os coloides poden ser moi variados. Quizá os máis utilizados na industria son as emulsiones. Una sociedade sen emulsiones sería hoxe inimaxinable: moitos medicamentos, asfalto, manteiga, pasta de dentes, cremas corporais, produtos agrícolas, etc. son emulsiones. Ao tratarse dun grupo grande, a comprensión das características físico-químicas das emulsiones é de gran importancia paira a vida cotiá.
As emulsiones son dispersións entre dous líquidos insolubles, termodinámicamente inestables. Normalmente uno dos dous líquidos é a auga e o outro calquera outro que non sexa soluble en auga, que xeralmente definiremos como aceite. As emulsiones poden ser, por tanto, pingas de aceite dispersadas en auga (ou/ou, por exemplo, leite) ou pingas de auga dispersadas en aceite (ou/ou, por exemplo, manteiga). Tanto ou como ou/ou o diámetro das gotitas de emulsión é duns 5-10 m. Na nosa vida diaria predominan as emulsiones ou/ou, das que se informará.
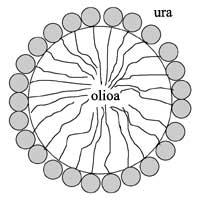
Como ambos os líquidos son insolubles, necesitamos algún axente de emulsión paira obter pingas de emulsión, é dicir, surfactantes (en inglés SURface Active AgeNT). Os surfactantes son moléculas anfílicas, é dicir, están formados por unha cabeza hidrófila que quere unirse á auga e una cola hidrófoba que quere unirse ao aceite. Por tanto, as colas hidrófobas oriéntanse cara á pinga de aceite e as cabezas hidrófilas cara á auga (ver debuxo 1). Así, grazas a esta singular estrutura, os surfactantes teñen a habilidade de reducir a tensión superficial e rodear as pingas. En mesturas de aceite de auga sen surfactante, a tensión superficial é moi alta e en moi pouco tempo as pingas de aceite uniríanse e quedarían dúas fases completamente diferentes. En xeral, os aceites usados son máis lixeiros que a auga, polo que a fase de aceite iríase elevando e na parte superior veríase a capa de aceite.

Como xa se comentou anteriormente, estas dispersións son termodinámicamente inestables, é dicir, cando o aceite, a auga e os surfactantes ponse á vez, as pingas de aceite non se xeran espontaneamente. Paira iso é necesario fornecer enerxía ao sistema. O obxectivo desta enerxía é aumentar a interfase oleo-auga na unidade de volume de aceite. Cantas máis pingas fagamos, máis pequenas serían, engadindo a interfase auga-aceite e obtendo una emulsión máis estable. A fonte de enerxía máis optativa paira a formación de pingas é o axitador, ou similar. Por tanto, seriamos capaces de preparar una emulsión seleccionando os aceites, augas e surfactantes adecuados e utilizando a enerxía necesaria.
O futuro da ciencia dos coloides

Existen coloides de diferente tamaño e aspecto na natureza, xa que os coloides non son só partículas pequenas, senón entidades químicas con estruturas moleculares e grupos funcionais diferentes. Tamén se demostrou que os sistemas coloides son capaces de resolver problemas que non poden resolverse con moléculas convencionais. Este principio non é novo, xa que a natureza utilizouno en millóns de anos. Uno dos exemplos máis sorprendentes é a estrutura do noso pelo: as moléculas de queratina engádense a distintos niveis até completar o pelo. Se comparamos as fibras fabricadas pola natureza coas fabricadas polo home, as primeiras presentan propiedades moito mellores. Outro exemplo ilustrativo é a nosa pel. Aínda que a estrutura é moi coñecida (auga, colágeno e algún ácido), até agora non se atopou material sintético tan duro, elástico e suave.
Os expertos están a investigar sobre a síntese de composites de materiais compostos de polímeros e coloides como a pel ou outros tecidos corporais. Está claro que aínda queda moito traballo por facer e, sen dúbida, o XXI. Una das ramas da ciencia que máis se desenvolverá no século XIX será a química dos coloides.
Contornos PARTICULARESOLOIDE-SISTEMASSasNieblas, aerosolSólidosPolvo, aerosolSolePolvo, aerosolévévÃsÃsÃsÃsÃsñosSolidificación, aerosois, Adoitamos,SolidificosñosEjemplos de Inversias.Datos históricos destacables
O uso dos coloides é tan antigo como as primeiras civilizacións. Paira obter a tinta de pintar, por exemplo, os exipcios engadían ás dispersións de carbono negro na auga a goma natural da árbore de acacia ou o albúmina da clara de ovo. As suspensións de ouro eran coñecidas polos alquimistas medievais que bebían como elixir da vida.

F. Selmi (1843) foi o primeiro investigador que estudou sistematicamente os coloides. A pesar dos intentos de disolver partículas de xofre e proteínas de leite caseína, aparecían varias veces suspensións de partículas pequenas. Os primeiros experimentos paira investigar as principais características dos coloides foron realizados polo científico inglés Graham en 1861. Por unha banda, decatouse de que os pequenos iones de sal e moléculas de azucre movíanse rapidamente e de que podían pasar facilmente una membrana mergullada na auga. Por outra banda, descubriu que as albúminas e gelatinas movíanse moi lentamente e que o seu tamaño era maior que os buracos da membrana. A palabra “coloide” foi a súa idea; kolla significa cola en grego e descubriu que os coloides actuaban como colas. Como consecuencia destes primeiros experimentos, por primeira vez os coloides comezaron a clasificarse por medida.
Quizá as primeiras observacións máis importantes sexan M. Foron realizados por Faraday en 1857. Este científico británico propúxose durante moitos anos estudar as características ópticas dos coloides, sendo as solucións máis traballadas as das partículas de ouro. Despois de facer atravesar una solución de ouro a un raio de luz, por unha banda, a solución era esbrancuxada. Con esta observación, Faraday detectou rapidamente que as partículas de ouro, do mesmo xeito que todos os coloides, dispersaban a luz. Outra diferenza entre os coloides e os iones salinos (Na+, Cl-) é que os iones non dispersan a luz, pero si os coloides.
XX. A principios do século XX moitos científicos seguiron estudando os coloides, e entre todos quizais o máis coñecido foi A. Einstein. Este científico alemán investigou, entre outras moitas cousas, o tamaño dos coloides, o movemento browniano e a reología. Sobre todo nesta última, realizou os seus esforzos máis destacados, logrando explicar a viscosidad das dispersións coloidales coa ecuación que leva o seu nome.
A mediados do século pasado desenvolvéronse as primeiras técnicas de análises do tamaño e peso molecular dos coloides. Tamén se inventaron técnicas paira o estudo da viscosidad das dispersións coloidales, análises de raios X, electroforesis, etc. Quizá desde que se coñecen ben os coloides, uno dos grandes inventos foi o microscopio electrónico. O primeiro desenvolveuse entre 1932 e 1940, sendo pioneiros alemáns, británicos e norteamericanos.
A importancia dos coloides na industria e a sociedade
Hoxe en día, a ciencia dos coloides ten una gran importancia en calquera aplicación. Nos medios de produción utilizados na industria petroleira, nos medicamentos, nos lácteos, nas pinturas, etc., é obrigatorio comprender ben a química dos coloides.
Una das áreas máis importantes dos coloides é a química dos alimentos. Existen decenas de alimentos compostos por coloides como leite, manteiga, queixo, salsas de todo tipo, maionesa e xeados. A empresa británica holandesa Unilever vende 500 millóns de litros de xeados cada ano.

As características dos coloides tamén teñen moito que ver na industria téxtil. A química superficial e a mojadura dos tecidos son moi importantes nos procesos de tinguido. En fotografía, impresoras e cerámica tamén predominan os coloides.
Dous exemplos importantes son os produtos agrícolas e o medicamento. Na primeira, a fertilidade da terra está asociada á abundancia de coloides. Canto máis arxilas e humus teña a terra, máis auga resistirá e, por tanto, as plantas terán máis nutrientes. Si en lugar de usar coloides utilizásense partículas maiores ou agregadas, a terra non aguantaría a auga con tanta facilidade e secaríase rapidamente. Doutra banda, se usásemos salgues inorgánicas, meteríanse no chan até o fondo e as plantas non terían posibilidade de sorber.
Outros moitos exemplos podémolos atopar en bioloxía. O sangue é una complexa solución de coloides. A nosa pel, os nosos músculos e diversos tecidos musculares do corpo teñen estruturas tipo xel, formadas por coloides. Quizá as moléculas máis importantes que podemos atopar no corpo de calquera animal son as proteínas, que, como se sabe hoxe en día, cumpren todas as características dos coloides nas súas solucións. Nos últimos anos demostrouse que a forma das proteínas que temos no noso corpo é absolutamente determinante. Por exemplo, os colágenos e os ósos da pel son moléculas construtivas con forma alargada. As proteínas que se atopan en sangue e leite teñen forma globular. Está claro que as moléculas longas están pensadas paira construír estruturas máis grandes, xa que se se atopasen en fluídos móbiles, como o sangue, poderían pechar calquera capilar con facilidade.
BIBLIOGRAFÍA
- Kaoru Tsujii Surface Activity, Principles, Phenomena and Applications . Academic Press (1998).
- Eric Dickinson An Introduction to Food Colloid s. Oxford Science Publications (1992).
- D. J. Introduction to Colloid and Surface Chemacer. 4th Ed, Butterworth-Heinemann Ltd (1992).





