Col·loides: què, on i per a què
Què tenen en comú els gelats, el ciment, el fum, la cervesa, el vaquer i els pesticides? Aquests i altres productes químics que utilitzem diàriament són els col·loides. Tots els col·loides estan formats per un mèdium homogeni i petites partícules disperses o disperses en ell. Altres col·loides que qualsevol coneix són la mantega, la sang i el paper.
La ciència dels col·loides estudia sistemes químics de dimensions intermèdies entre micròmetres (1 m = 10 -6 m) i nanòmetres (1 nm = 10 -9 m), és a dir, entitats químiques des de les partícules agregades més petites fins als àtoms o molècules més grans.
Encara que, en general, té molt a veure amb la química i la química física, la ciència dels col·loides és una recerca interdisciplinària. Sovint els col·loides són molt complexos i els estudis que es realitzen per a comprendre bé les seves característiques no són tan precisos com els científics desitjaven. Tal vegada sigui un sistema complex i que sigui ciència de diferents camps, durant molts anys i encara ho és, la majoria de les escoles i universitats no han estat exposades.
Col·loides de diferents tipus i grandàries
W. Ostwald XX. La primera classificació exacta dels col·loides es deu al científic guanyador del premi Nobel a principis del segle XX. Per primera vegada, tots els col·loides es van establir en forma de dispersió, i el científic rus alemany va decidir classificar-los per grandàries. Considera que les dispersions es poden classificar en tres grans grups: partícules i agregats majors de 10 -7 m, com el fang; dispersions col·loidals de 10 -7 -10 -9 m; i dispersions moleculars menors de 10 -9 m.
En l'actualitat també es consideren col·loides els sistemes de 2x10 -7 -5x10 -7 m. Per tant, com es va decidir a principis del segle passat, els col·loides són més grans que les molècules d'aigua, hidrogen o sucre, però més petits que les cèl·lules sanguínies i els bacteris.
El premi Nobel Staundiger, en lloc de fer-ho per mesura, va tenir en compte el nombre d'àtoms dels col·loides a l'hora de classificar-los. Staundiger creu que una partícula de col·loides hauria de contenir almenys mil àtoms. Una molècula d'aigua té tres àtoms i, per descomptat, no és un col·loide. Una molècula de sucre que dóna la planta de cabell blanc té 45 àtoms, que tampoc és col·loide.
El pes molecular d'una molècula orgànica de mil àtoms és d'uns 10.000 g/mol, i si aquests es col·loquessin al voltant d'una esfera formarien una partícula de 0,5-2 nm. Segons Staundiger, per tant, els col·loides haurien de tenir entre 10 3 i 10 9 àtoms.
EXTENSION DE DISPERSIÓ / 10 -9 mDiámetro del gra de quars 50.000-20.000 mDiámetro de la cèl·lula sanguínia humana7500 Diàmetre del bacteri Bacilus Coli 1500Diámetro de la partícula del col·loide de sofre 50-500Dimensiones del virus de la grip 120Diámetro de la partícula del col·loide d'or 1-100 Dimensions de la molècula elemental de dispersió d'oxigenCol·loides més importants: emulsions
Com hem vist al principi, els col·loides poden ser molt variats. Potser els més utilitzats en la indústria són les emulsions. Una societat sense emulsions seria avui inimaginable: molts medicaments, asfalt, mantega, pasta de dents, cremes corporals, productes agrícoles, etc. són emulsions. En tractar-se d'un grup gran, la comprensió de les característiques físic-químiques de les emulsions és de gran importància per a la vida quotidiana.
Les emulsions són dispersions entre dos líquids insolubles, termodinámicamente inestables. Normalment un dels dos líquids és l'aigua i l'altre qualsevol altre que no sigui soluble en aigua, que generalment definirem com a oli. Les emulsions poden ser, per tant, gotes d'oli dispersades en aigua (o/o, per exemple, llet) o gotes d'aigua dispersades en oli (o/o, per exemple, mantega). Tant o com o/o el diàmetre de les gotetes d'emulsió és d'uns 5-10 m. En la nostra vida diària predominen les emulsions o/o, de les quals s'informarà.
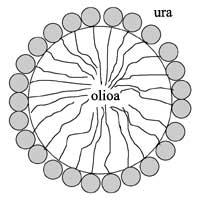
Com tots dos líquids són insolubles, necessitem algun agent d'emulsió per a obtenir gotes d'emulsió, és a dir, surfactants (en anglès SURface Activi AgeNT). Els surfactants són molècules anfílicas, és a dir, estan formats per un cap hidròfil que vol unir-se a l'aigua i una cua hidròfoba que vol unir-se a l'oli. Per tant, les cues hidròfobes s'orienten cap a la gota d'oli i els caps hidròfils cap a l'aigua (veure dibuix 1). Així, gràcies a aquesta singular estructura, els surfactants tenen l'habilitat de reduir la tensió superficial i envoltar les gotes. En mescles d'oli d'aigua sense surfactant, la tensió superficial és molt alta i en molt poc temps les gotes d'oli s'unirien i quedarien dues fases completament diferents. En general, els olis usats són més lleugers que l'aigua, per la qual cosa la fase d'oli s'aniria elevant i en la part superior es veuria la capa d'oli.

Com ja s'ha comentat anteriorment, aquestes dispersions són termodinámicamente inestables, és a dir, quan l'oli, l'aigua i els surfactants es posen alhora, les gotes d'oli no es generen espontàniament. Per a això és necessari subministrar energia al sistema. L'objectiu d'aquesta energia és augmentar la interfase oleo-aigua en la unitat de volum d'oli. Quantes més gotes fem, més petites serien, afegint la interfase aigua-oliï i obtenint una emulsió més estable. La font d'energia més optativa per a la formació de gotes és l'agitador, o similar. Per tant, seríem capaços de preparar una emulsió seleccionant els olis, aigües i surfactants adequats i utilitzant l'energia necessària.
El futur de la ciència dels col·loides

Existeixen col·loides de diferent grandària i aspecte en la naturalesa, ja que els col·loides no són només partícules petites, sinó entitats químiques amb estructures moleculars i grups funcionals diferents. També s'ha demostrat que els sistemes col·loides són capaços de resoldre problemes que no poden resoldre's amb molècules convencionals. Aquest principi no és nou, ja que la naturalesa l'ha utilitzat en milions d'anys. Un dels exemples més sorprenents és l'estructura del nostre pèl: les molècules de queratina s'afegeixen a diferents nivells fins a completar el pèl. Si comparem les fibres fabricades per la naturalesa amb les fabricades per l'home, les primeres presenten propietats molt millors. Un altre exemple il·lustratiu és la nostra pell. Encara que l'estructura és molt coneguda (aigua, col·lagen i algun àcid), fins ara no s'ha trobat material sintètic tan dur, elàstic i suau.
Els experts estan investigant sobre la síntesi de composites de materials composts de polímers i col·loides com la pell o altres teixits corporals. És clar que encara queda molta feina per fer i, sens dubte, el XXI. Una de les branques de la ciència que més es desenvoluparà en el segle XIX serà la química dels col·loides.
Contorns PARTICULARESOLOIDE-SISTEMASSasNieblas, aerosolSólidosPolvo, aerosolSolePolvo, aerosolévévÃsÃsÃsÃsÃsñosSolidificación, aerosols, Solem,SolidificosñosEjemplos d'Inversias.Dades històriques destacables
L'ús dels col·loides és tan antic com les primeres civilitzacions. Per a obtenir la tinta de pintar, per exemple, els egipcis afegien a les dispersions de carboni negre en l'aigua la goma natural de l'arbre d'acàcia o l'albúmina de la clara d'ou. Les suspensions d'or eren conegudes pels alquimistes medievals que bevien com a elixir de la vida.

F. Selmi (1843) va ser el primer investigador que va estudiar sistemàticament els col·loides. Malgrat els intents de dissoldre partícules de sofre i proteïnes de llet caseïna, apareixien diverses vegades suspensions de partícules petites. Els primers experiments per a investigar les principals característiques dels col·loides van ser realitzats pel científic anglès Graham en 1861. D'una banda, es va adonar que els petits ions de sal i molècules de sucre es movien ràpidament i que podien passar fàcilment una membrana submergida en l'aigua. D'altra banda, va descobrir que les albúmines i gelatines es movien molt lentament i que la seva grandària era major que els forats de la membrana. La paraula “col·loide” va ser la seva idea; kolla significa cua en grec i va descobrir que els col·loides actuaven com a cues. Com a conseqüència d'aquests primers experiments, per primera vegada els col·loides van començar a classificar-se per mesura.
Potser les primeres observacions més importants són M. Van ser realitzats per Faraday en 1857. Aquest científic britànic es va proposar durant molts anys estudiar les característiques òptiques dels col·loides, sent les solucions més treballades les de les partícules d'or. Després de fer travessar una solució d'or a un raig de llum, d'una banda, la solució era blanquinosa. Amb aquesta observació, Faraday va detectar ràpidament que les partícules d'or, igual que tots els col·loides, dispersaven la llum. Una altra diferència entre els col·loides i els ions salins (Na+, Cl-) és que els ions no dispersen la llum, però sí els col·loides.
XX. A principis del segle XX molts científics van continuar estudiant els col·loides, i entre tots potser el més conegut va ser A. Einstein. Aquest científic alemany va investigar, entre moltes altres coses, la grandària dels col·loides, el moviment browniano i la reologia. Sobretot en aquesta última, va realitzar els seus esforços més destacats, aconseguint explicar la viscositat de les dispersions col·loidals amb l'equació que porta el seu nom.
A mitjan segle passat es van desenvolupar les primeres tècniques d'anàlisis de la grandària i pes molecular dels col·loides. També es van inventar tècniques per a l'estudi de la viscositat de les dispersions col·loidals, anàlisis de raigs X, electroforesis, etc. Potser des que es coneixen bé els col·loides, un dels grans invents ha estat el microscopi electrònic. El primer es va desenvolupar entre 1932 i 1940, sent pioners alemanys, britànics i nord-americans.
La importància dels col·loides en la indústria i la societat
Avui dia, la ciència dels col·loides té una gran importància en qualsevol aplicació. En els mitjans de producció utilitzats en la indústria petroliera, en els medicaments, en els lactis, en les pintures, etc., és obligatori comprendre bé la química dels col·loides.
Una de les àrees més importants dels col·loides és la química dels aliments. Existeixen desenes d'aliments composts per col·loides com a llet, mantega, formatge, salses de tota mena, maionesa i gelats. L'empresa britànica holandesa Unilever embeni 500 milions de litres de gelats cada any.

Les característiques dels col·loides també tenen molt a veure en la indústria tèxtil. La química superficial i la mojadura dels teixits són molt importants en els processos de tenyit. En fotografia, impressores i ceràmica també predominen els col·loides.
Dos exemples importants són els productes agrícoles i la medicina. En la primera, la fertilitat de la terra està associada a l'abundància de col·loides. Com més argiles i humus tingui la terra, més aigua resistirà i, per tant, les plantes tindran més nutrients. Si en lloc d'usar col·loides s'utilitzessin partícules majors o agregades, la terra no aguantaria l'aigua amb tanta facilitat i s'assecaria ràpidament. D'altra banda, si uséssim sals inorgàniques, es ficarien en el sòl fins al fons i les plantes no tindrien possibilitat de xarrupar.
Molts altres exemples els podem trobar en biologia. La sang és una complexa solució de col·loides. La nostra pell, els nostres músculs i diversos teixits musculars del cos tenen estructures tipus gel, formades per col·loides. Potser les molècules més importants que podem trobar en el cos de qualsevol animal són les proteïnes, que, com se sap avui dia, compleixen totes les característiques dels col·loides en les seves solucions. En els últims anys s'ha demostrat que la forma de les proteïnes que tenim en el nostre cos és absolutament determinant. Per exemple, els col·làgens i els ossos de la pell són molècules constructives amb forma allargada. Les proteïnes que es troben en sang i llet tenen forma globular. És clar que les molècules llargues estan pensades per a construir estructures més grans, ja que si es trobessin en fluids mòbils, com la sang, podrien tancar qualsevol capil·lar amb facilitat.
BIBLIOGRAFIA
- Kaoru Tsujii Surface Activity, Principles, Phenomena and Applications . Academic Press (1998).
- Eric Dickinson An Introduction to Food Colloid s. Oxford Science Publications (1992).
- D. J. Introduction to Colloid and Surface Chemacer. 4th Ed, Butterworth-Heinemann Ltd (1992).





