Colloïdes : quoi, où et pourquoi
Qu'ont en commun les glaces, le ciment, la fumée, la bière, le jean et les pesticides ? Ces produits chimiques et d'autres que nous utilisons quotidiennement sont les colloïdes. Tous les colloïdes sont constitués d'un médium homogène et de petites particules dispersées ou dispersées. D'autres colloïdes que tout le monde connaît sont le beurre, le sang et le papier.
La science des colloïdes étudie les systèmes chimiques de dimensions intermédiaires entre les micromètres (1 m = 10 -6 m) et les nanomètres (1 nm = 10 -9 m), c'est-à-dire les entités chimiques des particules agrégées plus petites aux atomes ou molécules plus grandes.
Bien que, en général, il a beaucoup à voir avec la chimie et la chimie physique, la science des colloïdes est une recherche interdisciplinaire. Les colloïdes sont souvent très complexes et les études réalisées pour bien comprendre leurs caractéristiques ne sont pas aussi précises que les scientifiques le souhaitaient. C'est peut-être un système complexe et scientifique de différents domaines, pendant de nombreuses années et l'est encore, la plupart des écoles et des universités n'ont pas été exposées.
Colloïdes de différents types et tailles
W. Ostwald XX. La première classification exacte des colloïdes est due au scientifique lauréat du prix Nobel au début du XXe siècle. Pour la première fois, tous les colloïdes ont été mis en forme de dispersion, et le scientifique russe allemand a décidé de les classer par tailles. Il considère que les dispersions peuvent être classées en trois grands groupes: particules et agrégats supérieurs à 10 -7 m, comme la boue; dispersions colloïdales de 10 -7 -10 -9 m; et dispersions moléculaires inférieures à 10 -9 m.
Les systèmes 2x10 -7 -5x10 -7 m sont également considérés comme des colloïdes. Ainsi, comme décidé au début du siècle dernier, les colloïdes sont plus grands que les molécules d'eau, d'hydrogène ou de sucre, mais plus petits que les cellules sanguines et les bactéries.
Le prix Nobel Staundiger, au lieu de le faire par mesure, a tenu compte du nombre d'atomes des colloïdes au moment de les classer. Staundiger croit qu'une particule de colloïdes devrait contenir au moins mille atomes. Une molécule d'eau a trois atomes et, bien sûr, n'est pas un colloïde. Une molécule de sucre qui donne la plante de canne a 45 atomes, qui n'est pas non plus colloïde.
Le poids moléculaire d'une molécule organique de mille atomes est d'environ 10.000 g/mol, et si ceux-ci étaient placés autour d'une sphère ils formeraient une particule de 0,5-2 nm. Selon Staundiger, les colloïdes devraient donc avoir entre 10 3 et 10 9 atomes.
EXTENSION DE DISPERSION / 10 -9 mDiamètre du grain de quartz 50.000-20.000 mDiamètre de la cellule sanguine humaine7500 Diamètre de la bactérie Bacilus coli 1500Diamètre de la particule du colloïde de soufre 50-500Dimensions du virus de la grippe 120Diamètre de la particule du colloïde d'or 1-100 Dimensions de la molécule d'oxygène élémentaire de dispersionColloïdes les plus importants: émulsions
Comme nous l'avons vu au début, les colloïdes peuvent être très variés. Peut-être les plus utilisés dans l'industrie sont les émulsions. Une société sans émulsions serait aujourd'hui inimaginable: beaucoup de médicaments, asphalte, beurre, dentifrice, crèmes corporelles, produits agricoles, etc. sont des émulsions. En tant que grand groupe, la compréhension des caractéristiques physico-chimiques des émulsions est d'une grande importance pour la vie quotidienne.
Les émulsions sont des dispersions entre deux liquides insolubles, thermodynamiquement instables. Normalement l'un des deux liquides est l'eau et l'autre n'est pas soluble dans l'eau, que nous définirons généralement comme huile. Les émulsions peuvent donc être des gouttes d'huile dispersées dans l'eau (ou, par exemple, du lait) ou des gouttes d'eau dispersées dans l'huile (ou, par exemple, du beurre). Soit comme u/ou le diamètre des gouttelettes d'émulsion est d'environ 5-10 m. Dans notre vie quotidienne prédominent les émulsions ou/ou, dont ils seront informés.
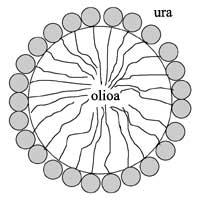
Comme les deux liquides sont insolubles, nous avons besoin d'un agent d'émulsion pour obtenir des gouttes d'émulsion, c'est-à-dire du surfactant (SURface ACTive AgeNT). Les surfactants sont des molécules amphibies, c'est-à-dire qu'ils sont constitués d'une tête hydrophile qui veut rejoindre l'eau et d'une queue hydrophobe qui veut rejoindre l'huile. Les queues hydrophobes sont donc orientées vers la goutte d'huile et les têtes hydrophiles vers l'eau (voir schéma 1). Ainsi, grâce à cette structure unique, les tensioactifs ont la capacité de réduire la tension superficielle et d'entourer les gouttes. Dans les mélanges d'huile d'eau sans surfactant, la tension superficielle est très élevée et en très peu de temps les gouttes d'huile se joindraient et il y aurait deux phases complètement différentes. En général, les huiles utilisées sont plus légères que l'eau, de sorte que la phase d'huile serait en hausse et sur le dessus serait voir la couche d'huile.

Comme déjà mentionné précédemment, ces dispersions sont thermodynamiquement instables, c'est-à-dire lorsque l'huile, l'eau et les tensioactifs sont mis à la fois, les gouttes d'huile ne sont pas générées spontanément. Pour cela, il est nécessaire de fournir de l'énergie au système. L'objectif de cette énergie est d'augmenter l'interface huile-eau dans l'unité de volume d'huile. Plus nous faisons de gouttes, plus elles seraient petites, en ajoutant l'interface eau-huile et en obtenant une émulsion plus stable. La source d'énergie la plus facultative pour la formation de gouttes est l'agitateur, ou similaire. Par conséquent, nous serions en mesure de préparer une émulsion en sélectionnant les huiles, les eaux et les tensioactifs appropriés et en utilisant l'énergie nécessaire.
L’avenir de la science des colloïdes

Il existe des colloïdes de taille et d'aspect différents dans la nature, car les colloïdes ne sont pas seulement de petites particules, mais des entités chimiques avec des structures moléculaires et des groupes fonctionnels différents. Il a également été démontré que les systèmes colloïdes sont capables de résoudre des problèmes qui ne peuvent être résolus par des molécules conventionnelles. Ce principe n'est pas nouveau, puisque la nature l'a utilisé en millions d'années. Un des exemples les plus surprenants est la structure de nos cheveux: les molécules de kératine sont ajoutés à différents niveaux jusqu'à compléter les cheveux. Si l'on compare les fibres fabriquées par la nature avec celles fabriquées par l'homme, les premières présentent des propriétés bien meilleures. Un autre exemple illustratif est notre peau. Bien que la structure soit bien connue (eau, collagène et acide), jusqu'à présent aucun matériau synthétique n'a été trouvé aussi dur, élastique et doux.
Les experts étudient la synthèse de composites de matériaux composites de polymères et de colloïdes comme la peau ou d'autres tissus corporels. Il est clair qu'il reste encore beaucoup de travail à faire et, sans doute, le XXI. Une des branches de la science qui se développera le plus au XIXe siècle sera la chimie des colloïdes.
Contours PARTICULARESOLOIDE-SYSTEMasBrouillards, aéroosolPoussière, aéroosoloidePoudre, aéroosols, Solennes,Solidifications-Exemples.Faits historiques remarquables
L'utilisation des colloïdes est aussi ancienne que les premières civilisations. Pour obtenir l'encre de peinture, par exemple, les Egyptiens ajoutaient aux dispersions de carbone noir dans l'eau le caoutchouc naturel de l'arbre d'acacia ou l'albumine du blanc d'oeuf. Les suspensions d'or étaient connues par les alchimistes médiévaux buvant comme élixir de la vie.

F. Selmi (1843) fut le premier chercheur à étudier systématiquement les colloïdes. Malgré les tentatives de dissoudre des particules de soufre et de protéines de lait caséine, des suspensions de petites particules apparaissaient plusieurs fois. Les premières expériences pour étudier les principales caractéristiques des colloïdes ont été faites par le scientifique anglais Graham en 1861. D'une part, il a été remarqué que les petits ions de sel et de molécules de sucre se déplaçaient rapidement et qu'ils pouvaient facilement passer une membrane immergée dans l'eau. D'autre part, il a découvert que les albumines et les gelées se déplaçaient très lentement et que leur taille était supérieure aux trous de la membrane. Le mot colloïde a été son idée; kolla signifie queue en grec et a découvert que les colloïdes ont agi comme des queues. À la suite de ces premières expériences, pour la première fois, les colloïdes ont commencé à être classés par mesure.
Les premières observations les plus importantes sont peut-être M. Ils ont été réalisés par Faraday en 1857. Ce scientifique britannique se propose pendant de nombreuses années d'étudier les caractéristiques optiques des colloïdes, les solutions les plus travaillées étant celles des particules d'or. Après avoir fait traverser une solution d'or à un rayon de lumière, d'une part, la solution était blanchâtre. Avec cette observation, Faraday a rapidement détecté que les particules d'or, comme tous les colloïdes, dispersaient la lumière. Une autre différence entre les colloïdes et les ions salins (Na+, Cl-) est que les ions ne dispersent pas la lumière, mais les colloïdes.
XX. Au début du 20e siècle, de nombreux scientifiques ont continué à étudier les colloïdes, et parmi tous peut-être le plus connu était A. Einstein. Ce scientifique allemand a étudié, entre autres, la taille des colloïdes, le mouvement brownien et la rhéologie. Surtout dans cette dernière, il a fait ses efforts les plus remarquables, parvenant à expliquer la viscosité des dispersions colloïdales avec l'équation qui porte son nom.
Au milieu du siècle dernier, les premières techniques d'analyse de la taille et du poids moléculaire des colloïdes ont été développées. Des techniques ont également été inventées pour l'étude de la viscosité des dispersions colloïdales, analyse des rayons X, électrophorèse, etc. Peut-être depuis que les colloïdes sont bien connus, une des grandes inventions a été le microscope électronique. Le premier se développa entre 1932 et 1940, pionniers allemands, britanniques et américains.
L'importance des colloïdes dans l'industrie et la société
Aujourd'hui, la science des colloïdes a une grande importance dans toute application. Dans les moyens de production utilisés dans l'industrie pétrolière, les médicaments, les produits laitiers, les peintures, etc., il est obligatoire de bien comprendre la chimie des colloïdes.
Une des zones les plus importantes des colloïdes est la chimie des aliments. Il existe des dizaines d'aliments composés de colloïdes comme le lait, le beurre, le fromage, les sauces de toutes sortes, la mayonnaise et la crème glacée. La société britannique hollandaise Unilever vend 500 millions de litres de crème glacée chaque année.

Les caractéristiques des colloïdes ont également beaucoup à voir dans l'industrie textile. La chimie superficielle et le mouillage des tissus sont très importants dans les processus de teinture. En photographie, imprimantes et céramique prédominent également les colloïdes.
Deux exemples importants sont les produits agricoles et la médecine. Dans la première, la fertilité de la terre est associée à l'abondance des colloïdes. Plus la terre a d'argiles et d'humus, plus l'eau résistera et les plantes auront donc plus de nutriments. Si, au lieu d'utiliser des colloïdes, on utilisait des particules plus importantes ou agrégées, la terre ne supporterait pas l'eau si facilement et sécherait rapidement. D'autre part, si nous utilisions des sels inorganiques, ils seraient mis dans le sol au fond et les plantes n'auraient pas la possibilité de sorber.
De nombreux autres exemples peuvent être trouvés en biologie. Le sang est une solution complexe de colloïdes. Notre peau, nos muscles et divers tissus musculaires du corps ont des structures de type gel, formées par des colloïdes. Peut-être les molécules les plus importantes que nous pouvons trouver dans le corps de n'importe quel animal sont les protéines, qui, comme on le sait aujourd'hui, remplissent toutes les caractéristiques des colloïdes dans leurs solutions. Ces dernières années, il a été démontré que la forme des protéines que nous avons dans notre corps est absolument déterminante. Par exemple, les collagènes et les os de la peau sont des molécules constructives de forme allongée. Les protéines qui se trouvent dans le sang et le lait ont une forme globulaire. Il est clair que les molécules longues sont conçues pour construire des structures plus grandes, car si elles se trouvaient dans des fluides mobiles, comme le sang, elles pourraient facilement fermer n'importe quelle capillaire.
BIBLIOGRAPHIE
- Kaoru Tsujii Surface Activity, Principles, Phenomena and Applications . Academic Press (1998).
- Eric Dickinson An Introduction to Food Colloid s. Oxford Science Publications (1992).
- D. J. Introduction to Colloid and Surface Chemacer. 4th Ed, Butterworth-Heinemann Ltd (1992).





