2006/10/01
224. zenbakia

eu es fr en cat gl
Aparecerá un contenido traducido automáticamente. ¿Deseas continuar?
Un contenu traduit automatiquement apparaîtra. Voulez-vous continuer?
An automatically translated content item will be displayed. Do you want to continue?
Apareixerà un contingut traduït automàticament. Vols continuar?
Aparecerá un contido traducido automaticamente. ¿Desexas continuar?
Tratando a radioactividade
Texto xerado polo tradutor automático Elia sen revisión posterior por tradutores.
Elia Elhuyar
Ao romper o núcleo do átomo obtense enerxía. Moita enerxía. Desgraciadamente este método é perigoso porque os residuos que quedan emiten radiación. Estes residuos pódense enterrar e mirar cara a outro lado, pero non é una boa solución. Que si non? Algúns físicos creen que os residuos se poden manipular paira reducir a radioactividade. Outros consideran que non é posible.
Tratando a radioactividade
01/10/2006 | Roia Zubia, Guillermo | Elhuyar Zientzia Komunikazioa

(Foto: De arquivo)
A solución do problema podería estar dentro do núcleo. Algúns núcleos emiten radiación e outro non. Si enténdese o porqué pode haber algunha maneira de manipular o núcleo.
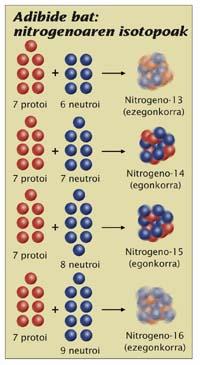
No núcleo hai protones e neutróns. Paira os químicos, os protones son os máis importantes; a química do átomo depende do número de protones, polo que os nomes dos elementos colocáronse en función do número de protones que teñen no núcleo do átomo. Por exemplo, calquera átomo que teña 7 protones é nitróxeno, independentemente dos neutróns que teña. Pero paira os físicos o número de neutróns tamén é importante. Un nitróxeno ten 6 neutróns ou 7 son moi diferentes. Ambos son nitróxeno, pero son dous isótopos, o 13 de nitróxeno e o 14 de nitróxeno, respectivamente (dáse nome ao elemento que representa os isótopos e o número de partículas do núcleo, os protones máis os neutros). O primeiro é radioactivo e o segundo é totalmente estable. A diferenza está no número de neutróns, o que é importante; en definitiva, paira saber si un determinado isótopo é radioactivo, hai que fixarse na proporción entre os protones e os neutróns.
Para que o núcleo sexa estable, os protones necesitan neutróns e ademais en cantidade adecuada. Nin demasiado neutróns nin demasiado poucos. Pero, canto é iso? Cantos neutróns necesita o núcleo paira non ser radioactivo por protón? Non hai una resposta sinxela. Na maioría dos átomos pequenos cúmprese a lei de igualdade: cantos protones, varios neutróns.
Igualdade
(Foto: G. Roia)
O núcleo helio-4 (2 protones, 2 neutróns) é un bo exemplo. Moi estable. É máis, os núcleos formados por varias unidades do núcleo helio-4 son tamén moi estables: 12 de carbono (6 protones, 6 neutróns, 3 unidades), 16 de osíxeno (8 protones, 8 neutróns, 4 unidades), etc. Existen excepcións, por exemplo, o núcleo berilio-8 (dous helio-4 unidades) é radioactivo. Con todo, en xeral, os núcleos pequenos co mesmo número de protones e neutróns son estables.
Con todo, esta tendencia finaliza co núcleo calcio-40. En átomos maiores, o núcleo necesita máis neutróns que protones paira manterse estable. Por exemplo, o isótopo estable máis abundante do ferro ten 26 protones e 30 neutróns. Ten 1,15 neutróns por protón. No caso do ouro, esta relación é maior, xa que o único isótopo estable é de 79 protones e 118 neutróns. É dicir, a máis átomo pesado, maior proporción. No caso do bismuto, 83 protones e 126 neutróns, a relación chega ao número 1,52. En átomos maiores que o bismuto a situación é grave; son moitos protones e non se pode meter no núcleo tantos neutróns como paira estabilizar un número tan grande de protones.
Resposta radioactiva
A radioactividade é o proceso que se dá paira equilibrar os neutróns que sobran ou faltan. En ambos os casos o proceso é moi diferente. En ambas as emítense partículas e enerxía, pero de forma moi diferente.

Os isótopos máis abundantes no universo son o 1 de hidróxeno e o 4 de helio.
PLATAFORMA
Cando hai demasiados neutróns, o núcleo presenta una situación difícil. O lóxico sería que os neutróns se expulsasen do núcleo, pero é case imposible expulsar un neutrón sen máis, necesítase moita enerxía. En lugar diso, o neutrón se desintegra. Ao ser una partícula neutra, a desintegración produce una partícula positiva e negativa, un protón e un electrón. (Ademais, neste proceso libérase outra partícula e enerxía). O protón queda no núcleo, polo que o átomo convértese noutro átomo ao ter un protón máis; o isótopo de carbono 14 (6 protones, 8 neutróns), por exemplo, convértese en 14 nitróxeno (7 protones, 7 neutróns) mediante un proceso deste tipo. Pola contra, o electrón é expulsado con gran enerxía. Esta radiación denomínase beta.
Cando os neutróns están demasiado baixos, o núcleo utiliza outra estratexia paira compensar esta falta: emite partículas alfa. As partículas Alfa están formadas por 2 protones e 2 neutróns, é dicir, son núcleos de helio 4. Como xa se mencionou, son moi estables, polo que non se necesita moita enerxía paira expulsar estas unidades do núcleo. O núcleo perde dous protones (convértese nun átomo máis pequeno) e desta maneira, dalgunha maneira, alivia a necesidade de neutróns. Non necesita tantos neutróns paira manterse estable. Por exemplo, o famoso uranio-238 transfórmase en torio-234 emitindo una partícula alfa.
Radioactividade de residuos
Os átomos menores de Bismuto-209 dificilmente emiten partículas alfa, normalmente radiación de núcleos pesados. De feito, os elementos relacionados coa problemática dos residuos nas centrais nucleares emiten partículas alfa. Un exemplo importante é o isótopo radio-226, un produto da fisión do uranio. Neste tipo de isótopos, se se tratase a radiación, habería que tratar a emisión de partículas alfa.

A estabilidade dos isótopos depende da proporción entre o número de protones e neutróns.
De arquivo
Habería que acelerar. Así, en lugar de emitir radiación durante moitos anos, esgotaríase no menor tempo posible. O propio isótopo Radio-226 ten una vida media de 1.600 anos. Isto significa que nese tempo se desintegra a metade da cantidade de radio, e tras o mesmo tempo, se desintegra a metade desa metade, é dicir, aínda queda una cuarta parte da cantidade inicial.
Pensa canto hai que esperar ata que se desintegre toda a radio. Por iso, o soterramento do radio (e outros residuos) non é una boa solución, xa que o problema persiste 'paira sempre', aínda que sexa subterráneo. E por iso os físicos queren inventar un proceso que acelere esta radioactividade. En lugar de enterrar o problema se desintegraría. Crese.
O mundo dos electróns

Os átomos dos metais están dispostos en malla. Nesta rede os núcleos están parados e algúns electróns móvense libremente por toda a rede. Por tanto, a rede é un medio con moitos electróns e pode utilizarse paira acelerar a emisión de partículas alfa.
De arquivo
Paira acelerar a emisión de partículas Alfa realizáronse diversas propostas. As contornas con moitos electróns son os que xeraron maior esperanza. A idea é sinxela: as partículas alfa teñen una carga positiva porque teñen dúas protones (como o seu nome indica, os neutróns son eléctricamente neutros); se se mergullan nun medio con moitos electróns, o medio "tiraría" ás partículas alfa paira saír do núcleo porque os electróns son cargas negativas. Por tanto, este medio negativo aceleraría a emisión de partículas alfa.
Trátase, por suposto, de atopar unha contorna adecuada. A última proposta foi realizada por físicos da Universidade Ruhr de Alemaña. O isótopo Polonio-210 é atrapado no interior dun metal e a súa temperatura baixa. A rede atómica do metal é un medio cheo de electróns que se arrefría para que os átomos permanezan o máis lentos posibles. Desta maneira afectaron ao isótopo radioactivo.
Segundo os físicos, os resultados son positivos. Agora queren tentar facer o mesmo co isótopo radio-226. Este isótopo ten una vida media de 1.600 anos e, segundo os físicos alemáns, pode descender a uns 100 anos. E con máis investigacións, pode lograrse una vida media máis curta.
Pero non todos os físicos creen iso. Nas probas realizadas por físicos da Universidade de Oxford non conseguiron acurtar a vida media. Ademais, en resumo, esta metodoloxía debería adaptarse ás centrais nucleares. Se o isótopo é forzosamente refrigerado, é difícil pór en marcha un proceso eficiente, xa que o arrefriado tamén require moita enerxía.

Se houbese una redución da vida media de varios isótopos que se producen na fisión nuclear, estariamos en vías de solucionar o problema dos residuos.
De arquivo
A proposta alemá ha xerado un gran debate entre investigadores e blogs de Física. En definitiva, o control da radioactividade podería ser una utopía.
O paradoxo do átomo perfecto
Non é práctico expresar o peso dos átomos en gramos. Son demasiado pequenos paira iso. Por iso, os físicos inventaron a unidade atómica e deron o peso de todos os átomos en función dela.
Paira definir a nova unidade necesitaban una referencia e utilizaron un átomo perfecto, o carbono. O carbono 12 é a base da vida e o isótopo máis abundante, está formado por unha estrutura perfecta, con seis protones e seis neutróns no núcleo. Por iso os científicos decidiron que o peso do núcleo perfecto do átomo perfecto sería de 12 unidades atómicas. Ao estar formada por 12 partículas, cada una delas pesaría una unidade de media.
Pero esta decisión supuxo una sorpresa paira os físicos. A partir desta referencia, calcularon o peso dun protón libre e dun neutrón libre en unidades atómicas. Os resultados de ambas as medicións foron 1,00734 e 1,00867 respectivamente. Por tanto, se as medidas realizáronse correctamente (e fixérono ben), estas doce partículas pesaban máis cando estaban soltas (12,09606) que cando estaban xuntas no núcleo do átomo (por definición, 12,0000). Onde estaba a masa perdida? A resposta de Einstein.

Albert Einstein.
(Foto: E. Karsh)
A unión de seis protones e seis neutróns nun núcleo require una reacción de fusión na que se libera una gran enerxía. Canto? Segundo a Teoría Especial da Relatividad, a que proporciona a fórmula E = mc 2. Canto máis masa pérdese, menos enerxía ten o núcleo e máis estable é.
Se este cálculo realízase con todos os átomos, está claro que cada un perde una cantidade de masa ao formar o núcleo, é dicir, uns núcleos son máis estables que outros. (A excepción é o núcleo hidrogeno-1, formado por un único protón (libre), polo que o núcleo e o protón libre pesan igual).
O núcleo máis estable é o ferro 56. E a partir de aí, se ascendemos ou descendemos pola táboa periódica, non se atopa un núcleo que perda tanta masa. Por iso, a fusión das estrelas xera moito máis ferro na táboa periódica que na que se atopan á súa ao redor. As excepcións son o 1 de hidróxeno e o 4 de helio, xa que na práctica son materias primas da fusión das estrelas.
Números máxicos
No núcleo só algunhas proporcións entre o número de protones e neutróns son estables. A maioría son radioactivos. A razón diso atópase na estrutura do núcleo, dalgunha maneira organizada por capas, do mesmo xeito que os electróns atópanse nos orbitais. De feito, os físicos descubriron que determinadas cantidades de partículas estabilizaban as capas ao deixalas cheas, o que reduce os niveis enerxéticos ao núcleo. Estes números, chamados números máxicos, son:
2, 8, 20, 28, 50, 82, 126
A presenza de dúas protones ou dous neutróns na primeira capa estabiliza o núcleo (ou dous protones e dous neutróns no caso do isótopo de helio-4) a presenza de oito na segunda. E así tamén cos seguintes. Isto non significa que non sexa posible ningunha combinación, pero cando o número de neutróns ou protones é un número máxico, o núcleo é especialmente estable.
Ponte Roia, Guillermo
Servizos
224
2006
Servizos
035
Física
Artigo
Servizos












