2006/10/01
224. zenbakia

eu es fr en cat gl
Aparecerá un contenido traducido automáticamente. ¿Deseas continuar?
Un contenu traduit automatiquement apparaîtra. Voulez-vous continuer?
An automatically translated content item will be displayed. Do you want to continue?
Apareixerà un contingut traduït automàticament. Vols continuar?
Aparecerá un contido traducido automaticamente. ¿Desexas continuar?
Tratando la radiactividad
Texto generado por el traductor automático Elia sin revisión posterior por traductores.
Elia Elhuyar
Al romper el núcleo del átomo se obtiene energía. Mucha energía. Desgraciadamente este método es peligroso porque los residuos que quedan emiten radiación. Estos residuos se pueden enterrar y mirar hacia otro lado, pero no es una buena solución. ¿Qué si no? Algunos físicos creen que los residuos se pueden manipular para reducir la radiactividad. Otros consideran que no es posible.
Tratando la radiactividad
01/10/2006 | Roa Zubia, Guillermo | Elhuyar Zientzia Komunikazioa

(Foto: De archivo)
La solución del problema podría estar dentro del núcleo. Algunos núcleos emiten radiación y otros no. Si se entiende el porqué puede haber alguna manera de manipular el núcleo.
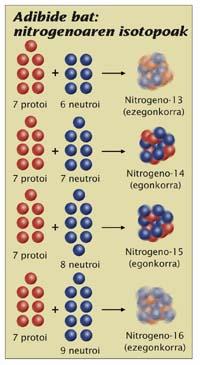
En el núcleo hay protones y neutrones. Para los químicos, los protones son los más importantes; la química del átomo depende del número de protones, por lo que los nombres de los elementos se colocaron en función del número de protones que tienen en el núcleo del átomo. Por ejemplo, cualquier átomo que tenga 7 protones es nitrógeno, independientemente de los neutrones que tenga. Pero para los físicos el número de neutrones también es importante. Un nitrógeno tiene 6 neutrones o 7 son muy diferentes. Ambos son nitrógeno, pero son dos isótopos, el 13 de nitrógeno y el 14 de nitrógeno, respectivamente (se da nombre al elemento que representa los isótopos y el número de partículas del núcleo, los protones más los neutros). El primero es radiactivo y el segundo es totalmente estable. La diferencia está en el número de neutrones, lo que es importante; en definitiva, para saber si un determinado isótopo es radiactivo, hay que fijarse en la proporción entre los protones y los neutrones.
Para que el núcleo sea estable, los protones necesitan neutrones y además en cantidad adecuada. Ni demasiado neutrones ni demasiado pocos. Pero, ¿cuánto es eso? ¿Cuántos neutrones necesita el núcleo para no ser radiactivo por protón? No hay una respuesta sencilla. En la mayoría de los átomos pequeños se cumple la ley de igualdad: cuántos protones, varios neutrones.
Igualdad
(Foto: G. Roa)
El núcleo helio-4 (2 protones, 2 neutrones) es un buen ejemplo. Muy estable. Es más, los núcleos formados por varias unidades del núcleo helio-4 son también muy estables: 12 de carbono (6 protones, 6 neutrones, 3 unidades), 16 de oxígeno (8 protones, 8 neutrones, 4 unidades), etc. Existen excepciones, por ejemplo, el núcleo berilio-8 (dos helio-4 unidades) es radiactivo. Sin embargo, en general, los núcleos pequeños con el mismo número de protones y neutrones son estables.
Sin embargo, esta tendencia finaliza con el núcleo calcio-40. En átomos mayores, el núcleo necesita más neutrones que protones para mantenerse estable. Por ejemplo, el isótopo estable más abundante del hierro tiene 26 protones y 30 neutrones. Tiene 1,15 neutrones por protón. En el caso del oro, esta relación es mayor, ya que el único isótopo estable es de 79 protones y 118 neutrones. Es decir, a más átomo pesado, mayor proporción. En el caso del bismuto, 83 protones y 126 neutrones, la relación llega al número 1,52. En átomos mayores que el bismuto la situación es grave; son muchos protones y no se puede meter en el núcleo tantos neutrones como para estabilizar un número tan grande de protones.
Respuesta radiactiva
La radiactividad es el proceso que se da para equilibrar los neutrones que sobran o faltan. En ambos casos el proceso es muy diferente. En ambas se emiten partículas y energía, pero de forma muy diferente.

Los isótopos más abundantes en el universo son el 1 de hidrógeno y el 4 de helio.
ANDÉN
Cuando hay demasiados neutrones, el núcleo presenta una situación difícil. Lo lógico sería que los neutrones se expulsaran del núcleo, pero es casi imposible expulsar un neutrón sin más, se necesita mucha energía. En lugar de eso, el neutrón se desintegra. Al ser una partícula neutra, la desintegración produce una partícula positiva y negativa, un protón y un electrón. (Además, en este proceso se libera otra partícula y energía). El protón se queda en el núcleo, por lo que el átomo se convierte en otro átomo al tener un protón más; el isótopo de carbono 14 (6 protones, 8 neutrones), por ejemplo, se convierte en 14 nitrógeno (7 protones, 7 neutrones) mediante un proceso de este tipo. Por el contrario, el electrón es expulsado con gran energía. Esta radiación se denomina beta.
Cuando los neutrones están demasiado bajos, el núcleo utiliza otra estrategia para compensar esta falta: emite partículas alfa. Las partículas Alfa están formadas por 2 protones y 2 neutrones, es decir, son núcleos de helio 4. Como ya se ha mencionado, son muy estables, por lo que no se necesita mucha energía para expulsar estas unidades del núcleo. El núcleo pierde dos protones (se convierte en un átomo más pequeño) y de esta manera, de alguna manera, alivia la necesidad de neutrones. No necesita tanto neutrones para mantenerse estable. Por ejemplo, el famoso uranio-238 se transforma en torio-234 emitiendo una partícula alfa.
Radiactividad de residuos
Los átomos menores de Bismuto-209 difícilmente emiten partículas alfa, normalmente radiación de núcleos pesados. De hecho, los elementos relacionados con la problemática de los residuos en las centrales nucleares emiten partículas alfa. Un ejemplo importante es el isótopo radio-226, un producto de la fisión del uranio. En este tipo de isótopos, si se tratase la radiación, habría que tratar la emisión de partículas alfa.

La estabilidad de los isótopos depende de la proporción entre el número de protones y neutrones.
De archivo
Habría que acelerar. Así, en lugar de emitir radiación durante muchos años, se agotaría en el menor tiempo posible. El propio isótopo Radio-226 tiene una vida media de 1.600 años. Esto significa que en ese tiempo se desintegra la mitad de la cantidad de radio, y tras el mismo tiempo, se desintegra la mitad de esa mitad, es decir, todavía queda una cuarta parte de la cantidad inicial.
Piensa cuánto hay que esperar hasta que se desintegre toda la radio. Por ello, el soterramiento del radio (y otros residuos) no es una buena solución, ya que el problema persiste 'para siempre', aunque sea subterráneo. Y por eso los físicos quieren inventar un proceso que acelere esta radiactividad. En lugar de enterrar el problema se desintegraría. Se cree.
El mundo de los electrones

Los átomos de los metales están dispuestos en malla. En esta red los núcleos están parados y algunos electrones se mueven libremente por toda la red. Por tanto, la red es un medio con muchos electrones y puede utilizarse para acelerar la emisión de partículas alfa.
De archivo
Para acelerar la emisión de partículas Alfa se han realizado diversas propuestas. Los entornos con muchos electrones son los que han generado mayor esperanza. La idea es sencilla: las partículas alfa tienen una carga positiva porque tienen dos protones (como su nombre indica, los neutrones son eléctricamente neutros); si se sumergen en un medio con muchos electrones, el medio "tiraría" a las partículas alfa para salir del núcleo porque los electrones son cargas negativas. Por tanto, este medio negativo aceleraría la emisión de partículas alfa.
Se trata, por supuesto, de encontrar un entorno adecuado. La última propuesta ha sido realizada por físicos de la Universidad Ruhr de Alemania. El isótopo Polonio-210 es atrapado en el interior de un metal y su temperatura baja. La red atómica del metal es un medio lleno de electrones que se enfría para que los átomos permanezcan lo más lentos posibles. De esta manera han afectado al isótopo radiactivo.
Según los físicos, los resultados son positivos. Ahora quieren intentar hacer lo mismo con el isótopo radio-226. Este isótopo tiene una vida media de 1.600 años y, según los físicos alemanes, puede descender a unos 100 años. Y con más investigaciones, puede lograrse una vida media más corta.
Pero no todos los físicos creen eso. En las pruebas realizadas por físicos de la Universidad de Oxford no han conseguido acortar la vida media. Además, en resumen, esta metodología debería adaptarse a las centrales nucleares. Si el isótopo es forzosamente refrigerado, es difícil poner en marcha un proceso eficiente, ya que el enfriamiento también requiere mucha energía.

Si hubiera una reducción de la vida media de varios isótopos que se producen en la fisión nuclear, estaríamos en vías de solucionar el problema de los residuos.
De archivo
La propuesta alemana ha generado un gran debate entre investigadores y blogs de Física. En definitiva, el control de la radiactividad podría ser una utopía.
La paradoja del átomo perfecto
No es práctico expresar el peso de los átomos en gramos. Son demasiado pequeños para ello. Por ello, los físicos inventaron la unidad atómica y dieron el peso de todos los átomos en función de ella.
Para definir la nueva unidad necesitaban una referencia y utilizaron un átomo perfecto, el carbono. El carbono 12 es la base de la vida y el isótopo más abundante, está formado por una estructura perfecta, con seis protones y seis neutrones en el núcleo. Por eso los científicos decidieron que el peso del núcleo perfecto del átomo perfecto sería de 12 unidades atómicas. Al estar formada por 12 partículas, cada una de ellas pesaría una unidad de media.
Pero esta decisión supuso una sorpresa para los físicos. A partir de esta referencia, calcularon el peso de un protón libre y de un neutrón libre en unidades atómicas. Los resultados de ambas mediciones fueron 1,00734 y 1,00867 respectivamente. Por lo tanto, si las medidas se habían realizado correctamente (y lo hicieron bien), estas doce partículas pesaban más cuando estaban sueltas (12,09606) que cuando estaban juntas en el núcleo del átomo (por definición, 12,0000). ¿Dónde estaba la masa perdida? La respuesta de Einstein.

Albert Einstein.
(Foto: Y. Karsh)
La unión de seis protones y seis neutrones en un núcleo requiere una reacción de fusión en la que se libera una gran energía. ¿Cuánto? Según la Teoría Especial de la Relatividad, la que proporciona la fórmula E = mc 2. Cuanto más masa se pierde, menos energía tiene el núcleo y más estable es.
Si este cálculo se realiza con todos los átomos, está claro que cada uno pierde una cantidad de masa al formar el núcleo, es decir, unos núcleos son más estables que otros. (La excepción es el núcleo hidrogeno-1, formado por un único protón (libre), por lo que el núcleo y el protón libre pesan igual).
El núcleo más estable es el hierro 56. Y a partir de ahí, si ascendemos o descendemos por la tabla periódica, no se encuentra un núcleo que pierda tanta masa. Por ello, la fusión de las estrellas genera mucho más hierro en la tabla periódica que en la que se encuentran a su alrededor. Las excepciones son el 1 de hidrógeno y el 4 de helio, ya que en la práctica son materias primas de la fusión de las estrellas.
Números mágicos
En el núcleo sólo algunas proporciones entre el número de protones y neutrones son estables. La mayoría son radiactivos. La razón de ello se encuentra en la estructura del núcleo, de alguna manera organizada por capas, al igual que los electrones se encuentran en los orbitales. De hecho, los físicos descubrieron que determinadas cantidades de partículas estabilizaban las capas al dejarlas llenas, lo que reduce los niveles energéticos al núcleo. Estos números, llamados números mágicos, son:
2, 8, 20, 28, 50, 82, 126
La presencia de dos protones o dos neutrones en la primera capa estabiliza el núcleo (o dos protones y dos neutrones en el caso del isótopo de helio-4) la presencia de ocho en la segunda. Y así también con los siguientes. Esto no significa que no sea posible ninguna combinación, pero cuando el número de neutrones o protones es un número mágico, el núcleo es especialmente estable.
Puente Roa, Guillermo
Servicios
224
2006
Servicios
035
Física
Artículo
Servicios












