2006/10/01
224. zenbakia

eu es fr en cat gl
Aparecerá un contenido traducido automáticamente. ¿Deseas continuar?
Un contenu traduit automatiquement apparaîtra. Voulez-vous continuer?
An automatically translated content item will be displayed. Do you want to continue?
Apareixerà un contingut traduït automàticament. Vols continuar?
Aparecerá un contido traducido automaticamente. ¿Desexas continuar?
Tractant la radioactivitat
Text generat pel traductor automàtic Elia sense revisió posterior per traductors.
Elia Elhuyar
En trencar el nucli de l'àtom s'obté energia. Molta energia. Desgraciadament aquest mètode és perillós perquè els residus que queden emeten radiació. Aquests residus es poden enterrar i mirar cap a un altre costat, però no és una bona solució. Què si no? Alguns físics creuen que els residus es poden manipular per a reduir la radioactivitat. Uns altres consideren que no és possible.
Tractant la radioactivitat
01/10/2006 | Rosegui Zubia, Guillermo | Elhuyar Zientzia Komunikazioa

(Foto: D'arxiu)
La solució del problema podria estar dins del nucli. Alguns nuclis emeten radiació i uns altres no. Si s'entén el perquè pot haver-hi alguna manera de manipular el nucli.
En el nucli hi ha protons i neutrons. Per als químics, els protons són els més importants; la química de l'àtom depèn del nombre de protons, per la qual cosa els noms dels elements es van col·locar en funció del nombre de protons que tenen en el nucli de l'àtom. Per exemple, qualsevol àtom que tingui 7 protons és nitrogen, independentment dels neutrons que tingui. Però per als físics el nombre de neutrons també és important. Un nitrogen té 6 neutrons o 7 són molt diferents. Tots dos són nitrogen, però són dos isòtops, el 13 de nitrogen i el 14 de nitrogen, respectivament (es dóna nom a l'element que representa els isòtops i el nombre de partícules del nucli, els protons més els neutres). El primer és radioactiu i el segon és totalment estable. La diferència està en el nombre de neutrons, la qual cosa és important; en definitiva, per a saber si un determinat isòtop és radioactiu, cal fixar-se en la proporció entre els protons i els neutrons.
Perquè el nucli sigui estable, els protons necessiten neutrons i a més en quantitat adequada. Ni massa neutrons ni massa pocs. Però, quant és això? Quants neutrons necessita el nucli per a no ser radioactiu per protó? No hi ha una resposta senzilla. En la majoria dels àtoms petits es compleix la llei d'igualtat: quants protons, diversos neutrons.
Igualtat
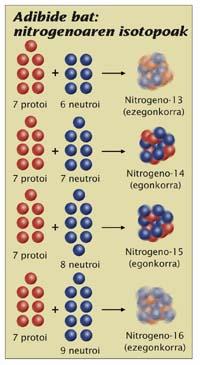
(Foto: G. Rosegui)
El nucli heli-4 (2 protons, 2 neutrons) és un bon exemple. Molt estable. És més, els nuclis formats per diverses unitats del nucli heli-4 són també molt estables: 12 de carboni (6 protons, 6 neutrons, 3 unitats), 16 d'oxigen (8 protons, 8 neutrons, 4 unitats), etc. Existeixen excepcions, per exemple, el nucli beril·li-8 (dos heli-4 unitats) és radioactiu. No obstant això, en general, els nuclis petits amb el mateix nombre de protons i neutrons són estables.
No obstant això, aquesta tendència finalitza amb el nucli calci-40. En àtoms majors, el nucli necessita més neutrons que protons per a mantenir-se estable. Per exemple, l'isòtop estable més abundant del ferro té 26 protons i 30 neutrons. Té 1,15 neutrons per protó. En el cas de l'or, aquesta relació és major, ja que l'únic isòtop estable és de 79 protons i 118 neutrons. És a dir, a més àtom pesat, major proporció. En el cas del bismut, 83 protons i 126 neutrons, la relació arriba al número 1,52. En àtoms majors que el bismut la situació és greu; són molts protons i no es pot ficar en el nucli tants neutrons com per a estabilitzar un número tan gran de protons.
Resposta radioactiva
La radioactivitat és el procés que es dóna per a equilibrar els neutrons que sobren o falten. En tots dos casos el procés és molt diferent. En ambdues s'emeten partícules i energia, però de forma molt diferent.

Els isòtops més abundants en l'univers són l'1 d'hidrogen i el 4 d'heli.
ANDANA
Quan hi ha massa neutrons, el nucli presenta una situació difícil. El lògic seria que els neutrons s'expulsessin del nucli, però és gairebé impossible expulsar un neutró sense més, es necessita molta energia. En lloc d'això, el neutró es desintegra. A l'ésser una partícula neutra, la desintegració produeix una partícula positiva i negativa, un protó i un electró. (A més, en aquest procés s'allibera una altra partícula i energia). El protó es queda en el nucli, per la qual cosa l'àtom es converteix en un altre àtom en tenir un protó més; l'isòtop de carboni 14 (6 protons, 8 neutrons), per exemple, es converteix en 14 nitrogen (7 protons, 7 neutrons) mitjançant un procés d'aquest tipus. Per contra, l'electró és expulsat amb gran energia. Aquesta radiació es denomina beta.
Quan els neutrons estan massa baixos, el nucli utilitza una altra estratègia per a compensar aquesta falta: emet partícules alfa. Les partícules Alfa estan formades per 2 protons i 2 neutrons, és a dir, són nuclis d'heli 4. Com ja s'ha esmentat, són molt estables, per la qual cosa no es necessita molta energia per a expulsar aquestes unitats del nucli. El nucli perd dos protons (es converteix en un àtom més petit) i d'aquesta manera, d'alguna manera, alleuja la necessitat de neutrons. No necessita tant neutrons per a mantenir-se estable. Per exemple, el famós urani-238 es transforma en tori-234 emetent una partícula alfa.
Radioactivitat de residus
Els àtoms menors de Bismut-209 difícilment emeten partícules alfa, normalment radiació de nuclis pesants. De fet, els elements relacionats amb la problemàtica dels residus en les centrals nuclears emeten partícules alfa. Un exemple important és l'isòtop radio-226, un producte de la fissió de l'urani. En aquesta mena d'isòtops, si es tractés la radiació, caldria tractar l'emissió de partícules alfa.

L'estabilitat dels isòtops depèn de la proporció entre el nombre de protons i neutrons.
D'arxiu
Caldria accelerar. Així, en lloc d'emetre radiació durant molts anys, s'esgotaria en el menor temps possible. El propi isòtop Radi-226 té una vida mitjana de 1.600 anys. Això significa que en aquest temps es desintegra la meitat de la quantitat de radi, i després del mateix temps, es desintegra la meitat d'aquesta meitat, és a dir, encara queda una quarta part de la quantitat inicial.
Pensa quant cal esperar fins que es desintegri tota la ràdio. Per això, el soterrament del radi (i altres residus) no és una bona solució, ja que el problema persisteix 'per sempre', encara que sigui subterrani. I per això els físics volen inventar un procés que acceleri aquesta radioactivitat. En lloc d'enterrar el problema es desintegraria. Es creu.
El món dels electrons

Els àtoms dels metalls estan disposats en malla. En aquesta xarxa els nuclis estan parats i alguns electrons es mouen lliurement per tota la xarxa. Per tant, la xarxa és un mitjà amb molts electrons i pot utilitzar-se per a accelerar l'emissió de partícules alfa.
D'arxiu
Per a accelerar l'emissió de partícules Alfa s'han realitzat diverses propostes. Els entorns amb molts electrons són els que han generat major esperança. La idea és senzilla: les partícules alfa tenen una càrrega positiva perquè tenen dos protons (com el seu nom indica, els neutrons són elèctricament neutres); si se submergeixen en un mitjà amb molts electrons, el mitjà "tiraria" a les partícules alfa per a sortir del nucli perquè els electrons són càrregues negatives. Per tant, aquest mitjà negatiu acceleraria l'emissió de partícules alfa.
Es tracta, per descomptat, de trobar un entorn adequat. L'última proposta ha estat realitzada per físics de la Universitat Ruhr d'Alemanya. L'isòtop Poloni-210 és atrapat a l'interior d'un metall i la seva temperatura baixa. La xarxa atòmica del metall és un mitjà ple d'electrons que es refreda perquè els àtoms romanguin el més lents possibles. D'aquesta manera han afectat l'isòtop radioactiu.
Segons els físics, els resultats són positius. Ara volen intentar fer el mateix amb l'isòtop radio-226. Aquest isòtop té una vida mitjana de 1.600 anys i, segons els físics alemanys, pot descendir a uns 100 anys. I amb més recerques, pot aconseguir-se una vida mitjana més curta.
Però no tots els físics creuen això. En les proves realitzades per físics de la Universitat d'Oxford no han aconseguit escurçar la vida mitjana. A més, en resum, aquesta metodologia hauria d'adaptar-se a les centrals nuclears. Si l'isòtop és forçosament refrigerat, és difícil posar en marxa un procés eficient, ja que el refredament també requereix molta energia.

Si hi hagués una reducció de la vida mitjana de diversos isòtops que es produeixen en la fissió nuclear, estaríem en vies de solucionar el problema dels residus.
D'arxiu
La proposta alemanya ha generat un gran debat entre investigadors i blogs de Física. En definitiva, el control de la radioactivitat podria ser una utopia.
La paradoxa de l'àtom perfecte
No és pràctic expressar el pes dels àtoms en grams. Són massa petits per a això. Per això, els físics van inventar la unitat atòmica i van donar el pes de tots els àtoms en funció d'ella.
Per a definir la nova unitat necessitaven una referència i van utilitzar un àtom perfecte, el carboni. El carboni 12 és la base de la vida i l'isòtop més abundant, està format per una estructura perfecta, amb sis protons i sis neutrons en el nucli. Per això els científics van decidir que el pes del nucli perfecte de l'àtom perfecte seria de 12 unitats atòmiques. En estar formada per 12 partícules, cadascuna d'elles pesaria una unitat de mitjana.
Però aquesta decisió va suposar una sorpresa per als físics. A partir d'aquesta referència, van calcular el pes d'un protó lliure i d'un neutró lliure en unitats atòmiques. Els resultats de tots dos mesuraments van ser 1,00734 i 1,00867 respectivament. Per tant, si les mesures s'havien realitzat correctament (i ho van fer bé), aquestes dotze partícules pesaven més quan estaven soltes (12,09606) que quan estaven juntes en el nucli de l'àtom (per definició, 12,0000). On estava la massa perduda? La resposta d'Einstein.

Albert Einstein.
(Foto: I. Karsh)
La unió de sis protons i sis neutrons en un nucli requereix una reacció de fusió en la qual s'allibera una gran energia. Quant? Segons la Teoria Especial de la Relativitat, la que proporciona la fórmula E = mc 2. Com més massa es perd, menys energia té el nucli i més estable és.
Si aquest càlcul es realitza amb tots els àtoms, és clar que cadascun perd una quantitat de massa en formar el nucli, és a dir, uns nuclis són més estables que uns altres. (L'excepció és el nucli hidrogeno-1, format per un únic protó (lliure), per la qual cosa el nucli i el protó lliure pesen igual).
El nucli més estable és el ferro 56. I a partir d'aquí, si ascendim o descendim per la taula periòdica, no es troba un nucli que perdi tanta massa. Per això, la fusió de les estrelles genera molt més ferro en la taula periòdica que en la qual es troben al seu voltant. Les excepcions són l'1 d'hidrogen i el 4 d'heli, ja que en la pràctica són matèries primeres de la fusió de les estrelles.
Nombres màgics
En el nucli només algunes proporcions entre el nombre de protons i neutrons són estables. La majoria són radioactius. La raó d'això es troba en l'estructura del nucli, d'alguna manera organitzada per capes, igual que els electrons es troben en els orbitals. De fet, els físics van descobrir que determinades quantitats de partícules estabilitzaven les capes en deixar-les plenes, la qual cosa redueix els nivells energètics al nucli. Aquests números, anomenats nombres màgics, són:
2, 8, 20, 28, 50, 82, 126
La presència de dos protons o dos neutrons en la primera capa estabilitza el nucli (o dos protons i dos neutrons en el cas de l'isòtop d'heli-4) la presència de vuit en la segona. I així també amb els següents. Això no significa que no sigui possible cap combinació, però quan el nombre de neutrons o protons és un nombre màgic, el nucli és especialment estable.
Puente Rosegui, Guillermo
Serveis
224
2006
Serveis
035
Física
Article
Serveis












