Des médicaments au vaccin

En plus des traitements de remplacement, l'unité de biophysique de Leioa travaille sur l'obtention du vaccin.
"L'exemple le plus connu du manque de succès du vaccin aujourd'hui est celui du vaccin contre l'agent viral du sida de renommée fatale", phrase que l'on peut lire dans l'article "Stratégies du virus pour envahir les cellules" du magazine Elhuyar de janvier 1996. L'auteur, José Luis Nieva, est un chercheur qui a expliqué, entre autres, la nécessité de connaître la structure de la membrane cellulaire pour empêcher le virus d'accéder à la cellule à partir d'elle.
Près de quinze ans plus tard, ni la phrase ni l'explication de Nieva n'ont perdu d'actualité. Plus encore : Nieva continue à enquêter sur le mécanisme infectieux du virus du sida pour créer des stratégies contre lui.
Il travaille à l'Unité de Biophysique de Leioa, en collaboration avec des chercheurs locaux et d'autres groupes internationaux. L'un de ses objectifs est de concevoir des composés plus efficaces que les antirétroviraux actuellement utilisés dans le traitement du sida. Selon Nieva, avec les antirétroviraux actuels, il faut utiliser des doses élevées car « les cibles sont intracellulaires ». Par conséquent, ces antirétroviraux doivent traverser la membrane cellulaire, ce qui rend les doses élevées. "Pour l'éviter, on cherche maintenant des cibles extracellulaires. Nous sommes là, que le virus soit la cible », a précisé Nieva.
Ainsi, l'interaction existante entre les protéines épineuses du VIH à l'extérieur et la membrane cellulaire qui l'infecte est étudiée. Les protéines d'épine sont les clés que le VIH utilise pour les introduire dans la cellule et les introduire dans certaines serrures. Par conséquent, il infecte différents types de cellules. Nieva a expliqué en détail dans quel type de cellules et dans quel endroit de cellules l'interaction se produit : « Le virus du sida est spécialisé dans les lymphocytes, en raison de la présence de certains marqueurs. Un des marqueurs est le récepteur CD4 et deux autres sont CCR5 et CXCR4".
Ces marqueurs sont, donc, les serrures; si l'interaction entre eux et les clefs, c'est-à-dire les protéines épineuses, le virus ne peut pas entrer dans la cellule. En fait, il y a des personnes qui ont une immunité propre au sida. Ces personnes ont une mutation dans le CCR5 : en ayant la serrure muette, le VIH ne peut pas accéder aux lymphocytes. Les chercheurs veulent obtenir quelque chose de semblable.
Mais ce n'est pas facile. Pour commencer, toutes les serrures ne sont pas identiques. Nieva a déclaré : « Vous ne pouvez pas utiliser une cible si elle n'est pas redondante. Autrement dit, vous ne pouvez pas inhiber un élément de la cellule si vous n'avez pas de substitut, mais la cellule meurt". Le récepteur CD4 ne peut donc pas être utilisé car il n'a pas de substituts. En revanche, le CCR5 l'a, comme en témoignent les personnes qui l'ont muté. Il en va de même pour le marqueur CXCR4. « Par conséquent, les inhibiteurs peuvent se développer contre les deux, de sorte que la protéine d'épine ne puisse pas interagir avec le récepteur et le VIH ne puisse pas entrer dans le lymphocyte ». En fait, il existe déjà un médicament étonnant qui bloque le CCR5, mais il ne fonctionne pas dans tous les cas.
Cuirasses et anticorps
Une autre façon d'empêcher l'entrée est "habiller une cuirasse" à la cellule. Cette stratégie, développée dans l'Unité de Biophysique, consiste à transformer la membrane cellulaire. En fait, le VIH pénètre dans une zone donnée de la membrane, dans la zone de sphinx. Les chercheurs ont inhibé l'enzyme qui introduit une double liaison dans les sphinx. En conséquence, la membrane est régie et la membrane du VIH et celle de la cellule ne peuvent pas être fusionnées. Autrement dit, le virus ne peut traverser la cuirasse.

Dans tous les cas, Félix Goñi, directeur de l'Unité de Biophysique et chef de l'enquête, a averti qu'il «prendra» pour s'appliquer à la thérapie: "Pour y parvenir, il faut encore beaucoup de travail et d'abord nous avons besoin de quelqu'un qui finance la recherche".
Pendant ce temps, les chercheurs travaillent sur d'autres stratégies. Nieva se concentre sur les protéines épineuses. « Les protéines d'épine sont nécessaires pour le virus, pour les lier à la cellule », déclare Nieva. "Avec eux, il est inséré dans la cellule, il produit la fusion et étend un pore. L'objectif de notre travail est de comprendre cela, surtout la vaccination et la fusion ».
« Ici, nous avons deux options : utiliser comme cible les protéines épineuses ou les utiliser pour faire des vaccins », explique Nieva. En fait, le système immunitaire de la personne infectée génère des anticorps contre ces protéines, qui sont les structures qu'il connaît et considère étrangères. « Nous sommes là. D'une part, nous développons des molécules inhibiteurs pour que le VIH ne s'intègre pas dans la cellule et, d'autre part, nous élaborons des anticorps contre le GP41, composant de la protéine épine ».
Nieva avoue qu'elle travaille sur la recherche fondamentale. Ils ont réussi à développer pour le moment un inhibiteur qui fonctionne dans l'eau: "La molécule que nous avons développée occupe la place du liant naturel, mais nous avons besoin d'une molécule qui fonctionne au milieu de la membrane, pas seulement dans l'eau".
Sur le marché il ya un inhibiteur appelé Virip. "Nous travaillons sur le développement d'un inhibiteur comme lui", a souligné Nieva. Il ajoute qu'il y a quelques inhibiteurs qui influencent la fusion et donnent l'exemple à un. Il s'appelle Enragé et est utilisé à la clinique, mais pas dans les traitements conventionnels mais dans les thérapies de sauvetage. Il explique que ces thérapies sont utilisées chez les patients qui ont développé des multirésistances antirétrovirales. "Le furivirtide est utilisé pour le nettoyage de virus multirésistants du sang, car ils n'ont pas de résistance à elle. Mais nous ne cherchons pas à ce stade, nous essayons d'empêcher la vaccination du virus ».
objectif vaccinal
L'objectif final est d'obtenir le vaccin. C'est ce que Nieva accepte, et ils y font aussi des recherches. Il n'est pas facile, de nombreux anticorps ont été décrits qui se produisent dans l'infection, mais ne sont pas en mesure de bloquer l'infection. Certains sont intéressants pour les chercheurs: Nieva a mentionné 2F5 et 4E10: Surtout ceux-là, il n'y a pas beaucoup plus. Les deux sont des anticorps monoclonaux, détectés dans les corps des patients et agissant sur la zone dans laquelle sont intégrées les protéines épineuses dans la membrane cellulaire ».
L'hypothèse des chercheurs est que ces anticorps inhibent les zones de la protéine épine incrustée dans la membrane. Nieva a souligné que « c'est un paradigme assez nouveau, mais nous avons vu qu'il se produit dans la nature ». Par conséquent, il souligne la possibilité de se vacciner avec elle.
C'est précisément dans l'Unité de Biophysique que l'on travaille sur le développement d'une partie du vaccin. Les anticorps ajoutent aux liposomes fragments des protéines épineuses connues par les anticorps, et vaccinent les lapins pour voir leur réponse immunitaire. « Nous espérons que nos liposomes de peptide immunogène conviennent à des vaccins d'ADN que d'autres développent », explique Nieva. "Mais c'est très compliqué", a-t-il dit.
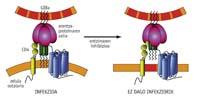
En outre, les progrès réalisés dans le laboratoire arrivent rarement à la clinique. Nieva a mis un exemple de quelques hexapeptides là développés. Ces hexapeptides sont des inhibiteurs de la protéine épine gp41, développés en 2006 et brevetés en 2008. Cependant, ils n'ont pas encore été développés pour la clinique. En fait, peu de composés dépassent la barrière.
Nieva le sait parfaitement : "Nous devons être réalistes. Sur mille composés brevetés, 30 viennent à des séances cliniques, trois dépassent les sessions cliniques et un seul d'entre eux avance ».






