Titani, coixí estabilitzador interior de bateries
Les bateries d'ió liti (VOL) van ser clau en el desenvolupament de dispositius portàtils, vehicles elèctrics i energies renovables. Avui dia, no obstant això, la indisponibilitat del liti, la desigual distribució del liti en el món i els danys ambientals que es deriven de la utilització de níquel (Ni) i cobalt (Co) en aquesta mena de bateries posen en dubte aquesta revolució.
A causa del desenvolupament dels últims anys, el cost i la disponibilitat de matèries primeres són importants, per la qual cosa s'ha comprovat que les bateries de sodi ió (NIB) poden arribar a ser substitutives de les OPS. Així, els òxids laminars de sodi i manganès (Na i Mn respectivament), sense Co i sense Ni, s'han fet molt interessants.
Aquest interès es deu en gran manera als processos electroquímics favorables i al fet que el principal metall de transició electroactivo sigui el Mn. En definitiva, el Mn és un element assequible, net i barat que, amb més d'una situació d'oxidació, permet la síntesi de compostos per a l'adaptació desitjada del potencial redox (el parell més utilitzat és Mn3+/Mn4+).
S'ha pogut comprovar que el dopatge d'aquests òxids laminos amb titani (Tu) millora la durabilitat de les bateries i pot provocar un millor manteniment de la capacitat en cada cicle de càrrega/descarrega. Però abans d'explicar el paper que juga el titani en això, vegem quina és l'estructura dels òxids laminats i quins són els seus principals problemes.
Components sandvitx
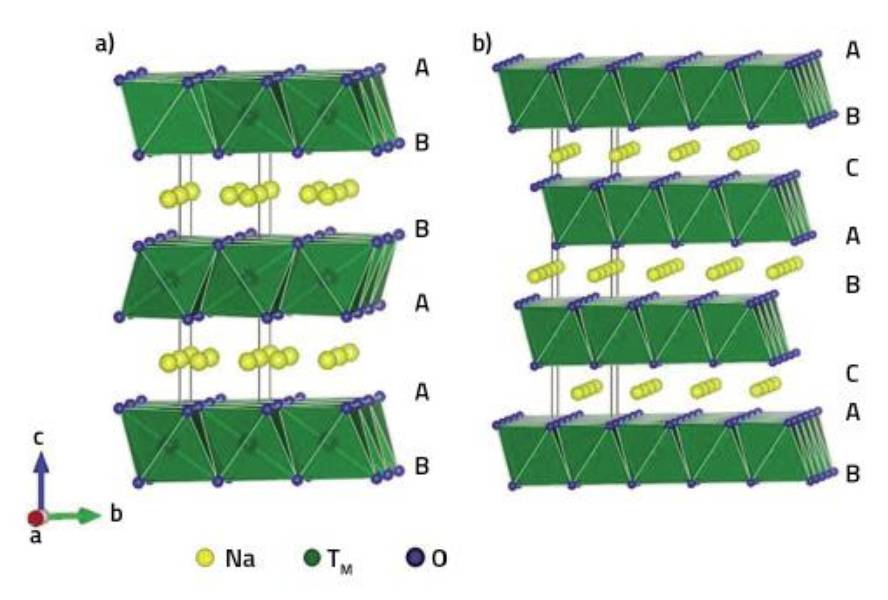
En els òxids laminats utilitzats per als càtodes de bateries de sodi ió es poden distingir capes d'oxigen, metalls de transició i sodi. Els metalls de transició es localitzen en els buits octaèdrics entre les dues capes d'oxigen, ocupant la resta de buits interoxigénicos. Així, en funció dels buits en els quals es localitzen els àtoms de sodi, es distingeixen les estructures tipus P i tipus O: Es denominen P quan els àtoms de sodi es troben en prismes trigonals i O quan estan en buits octaèdrics. També s'utilitzen números en el nom que indiquen el nombre de capes de sodi necessàries per a descriure tota l'estructura. D'aquesta forma, es poden disposar d'estructures tipus P2, O2 i O3 depenent de la posició relativa de les capes d'oxigen.
Estudis demostren que les estructures P són més apropiades per als càtodes de les bateries que les estructures O, ja que els àtoms de sodi es desplacen més fàcilment d'un prisma a un altre que d'un octaedre a un altre. No obstant això, en funció de les condicions i quantitat de sodi utilitzats, es produeixen transformacions de> P O, el que limita el procés de càrrega/descarrega de la bateria.
Manganès, element actiu
En els òxids laminars de manganès, l'element actiu és el Mn. És a dir, durant el procés de càrrega/descarrega de la bateria, quan els sodi s'extreuen/introdueixen de l'òxid laminar, el manganès capta/allibera els electrons del sodi, convertint-se en Mn3+/Mn4+. Aquest és el principal problema d'aquests òxids laminos. I és que, a diferència de Mn4+, Mn3+ sofreix una distorsió de Jahn-Teller (JT) a causa de la seva configuració electrònica. Com a conseqüència d'això, l'octaedre format pels sis oxígens al voltant del manganès s'allarga i escurça, i tenint en compte que en cada cicle de càrrega/descarrega es produeix la transformació de Mn3+{ Mn4+> Mn3+, la qual cosa afecta negativament l'òxid laminar durant cicles.
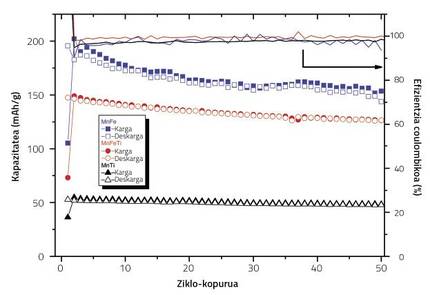
Per a fer front a aquest problema, els òxids laminars es dopen amb elements inactius, com el magnesi i el titani, que no capten/alliberen electrons durant el procés de càrrega/descarrega de la bateria. En aquest sentit, investigadors de CIC EnergiGUNE realitzem un estudi basat en el compost Na2/3Fe0,2 Mn0.8O2, que és l'òxid laminar de ferro i manganès que obté les condicions electroquímiques més favorables. En l'estudi vam veure que en dopar aquest compost amb diferents quantitats de titani, l'evolució de la capacitat de cicle a cicle canviava. Recentment, en un treball publicat en la revista Journal of Material Chemistry A, hem explicat el paper del titani en aquest sentit, combinant mesuraments electroquímics, espectroscopía d'absorció de raigs X i càlculs teòrics utilitzant la teoria de la densitat funcional (DFT).
En resum, es pot dir que el titani és capaç d'absorbir les distorsions d'octaedres dels metalls actius de la zona, en aquest cas el manganès. És a dir, encara que la configuració electrònica no produeixi distorsionis JT, el titani és capaç d'adaptar el seu octaedre a les distorsions de l'entorn. En essència, en ser més feble la unió titani-oxigen, adaptant-se als moviments de l'entorn, aquest metall es comporta en l'estructura com un coixí capaç de donar estabilitat a tota l'estructura.
En qualsevol cas, la concentració de titani ha de cuidar-se adequadament. L'estudi es va basar en el Na2/3Fe0,2 Mn350O2, que és el que obté la millor condició electroquímica entre els òxids laminats de ferro i manganès. En la recerca utilitzem tres concentracions de titani, de les quals només es van obtenir resultats satisfactoris. En absència de titani, a mesura que es feien cicles de càrrega/descarrega, la capacitat del càtode disminuïa notablement. Quan substituíem tot el ferro del compost per titani, la capacitat inicial disminuïa considerablement. En canvi, quan substituïm la meitat del ferro per titani, la capacitat inicial era adequada, així com la seva evolució cicle a cicle. De fet, a mesura que augmenta la concentració de titani, augmenta la concentració de Mn3+ que sofreixen l'estirament/escurçament dels seus octaedres, la qual cosa fa que la capacitat de la bateria sigui baixa des del principi. No obstant això, quan la concentració del dopant és menor, Mn3+ estarà menys en el compost, i a més de tenir una capacitat inicial més alta, la fulla del titani en l'estructura permet mantenir millor la capacitat cicle a cicle.
Com a reflex d'aquest caràcter, calculem teòricament els índexs de distorsió de tots els metalls de transició del compost (Fe, Tu, Mn3+ i Mn4+). Aquest índex ens indica quant s'allunya d'un octaedre regular format per sis oxígens al voltant de cada àtom del metall de transició.
Així, per als tres compostos analitzats, el catió Mn3+ era el que presentava major índex de distorsió. En l'altre extrem se situava Mn4+, el més pròxim a un octaedre regular. Això és fàcilment comprensible si tenim en compte que el catió Mn3+ sofreix distorsió JT per la seva configuració electrònica.
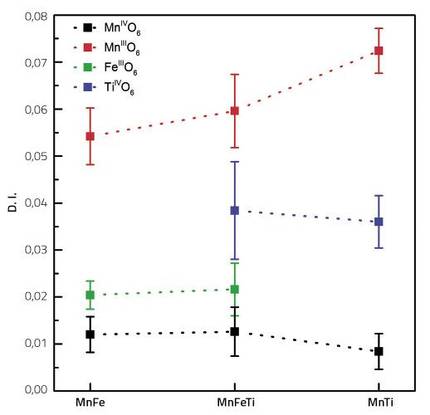
El més cridaner és la diferència entre Tu i Fe. L'índex de distorsió del titani és entre dues i tres vegades superior al del ferro. Bàsicament, aquests dos metalls de transició no haurien de presentar per si mateixos distorsions, ja que la seva configuració electrònica no els afecta. La distorsió d'aquests dos metalls inactius és deguda únicament a les distorsions dels octaedres circumdants. Així, el fet que l'índex de titani sigui dues o tres vegades superior al del ferro indica que el titani adapta millor les distorsions de la zona que el ferro. És a dir, si comparem els components inactius del càtode amb un coixí, el seu índex de distorsió indicaria el grau de flaccidesa del coixí. Com més gran sigui l'índex de distorsió, més flexible serà el coixí, la qual cosa facilitarà l'absorció de les irregularitats dels octaedres circumdants.
Pas a pas…
En aquell treball vam poder comprovar que el titani podria millorar la durada de les possibles bateries de sodi ió. És a dir, podríem carregar més sovint el portàtil o el vehicle elèctric que usés aquest tipus de bateries sense danyar massa la capacitat de la seva bateria.
No obstant això, aquest és un petit pas més en el camí de les bateries de sodi ió. Està per veure com afectarien altres dopants diferents del titani. Per exemple, s'ha pogut comprovar que a vegades s'obtenen resultats molt interessants fins i tot quan s'utilitza zinc com dopador, la qual cosa encara no s'entén molt bé.
Així mateix, en els òxids laminars tipus P2, quan es detecta presència de sodi en prismes que comparteixen una cara amb octaedres de metalls de transició, s'ha observat que la transformació P2> O2 es complica. Això facilita el procés de càrrega/descarrega de la bateria. Per tant, a més del dopant, caldrà tenir en compte la funció que pot tenir la posició dels àtoms de sodi.
En totes aquestes recerques estem involucrats diferents grups de recerca de la línia de bateries de sodi ió de CIC EnergiGUNE.





