Embarazo en mans de homes
Farmazian doktorea. Biofarmazia, Farmakozinetika eta Farmazia-teknologiako irakasle kolaboratzailea
Farmazia Fakultatea UPV-EHU, Vitoria-Gasteiz
Farmazian doktorea. Biofarmazia, Farmakozinetika eta Farmazia-teknologiako irakasle kolaboratzailea
Farmazia Fakultatea UPV-EHU, Vitoria-Gasteiz

A función dos científicos é facer preguntas á natureza e interpretar e pór en práctica as súas respostas. Seguindo co postulado, tomando como base os cambios hormonais que sofre a muller durante o embarazo, descubriuse que as hormonas externalizadas inhibían a ovulación e lanzáronse en 1960 os primeiros anticonceptivos hormonais paira as mulleres. Tras coñecer o éxito da terapia hormonal nas mulleres, era de esperar que se probase canto antes nos homes. Con todo, sobre todo por motivos socioculturais, tardáronse tres décadas en iniciar investigacións con maior seriedade sobre métodos anticonceptivos masculinos.
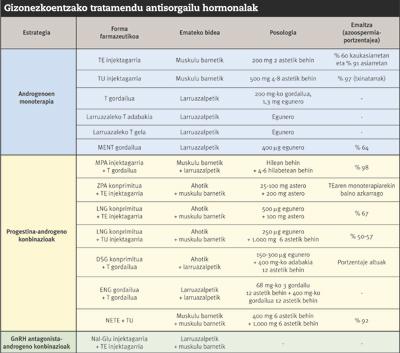
Na procura de anticonceptivos masculinos, ante a capacidade de reducir a produción de espermatozoides (espermatogenesis), déronse os primeiros pasos con testosterona. Os estudos realizados con testosterona teñen una evolución próxima aos 40 anos. En primeiro lugar, nos anos 70 tentouse determinar o tipo e dose de testosterona máis adecuadas paira inhibir a espermatogenesis. 20 anos despois, ao amparo da Organización Mundial da Saúde (OMS), realizáronse os dous primeiros estudos multinacionais paira medir a capacidade anticonceptiva da testosterona. Con todo, por diversas razóns, os resultados nunca foron moi satisfactorios. Por unha banda, a testosterona, que por vía oral produce una degradación hepática por inxección. Doutra banda, porque produce efectos secundarios importantes, como a testosterona produce a perda de libido e masa muscular. Ademais, desde o inicio do tratamento até a efectiva inhibición da espermatogénesis é un tempo longo (8-10 semanas).
A modo de exemplo, hai que mencionar as investigacións auspiciadas pola OMS na década dos 90, que foron un fito paira os seguintes. Nestas investigacións, un total de 670 individuos sans administrados por vía intramuscular o enantato de testosterona (CHE) unha vez á semana, demostrouse que era posible manter a espermatogenesis por baixo dos 3 millóns de espermatozoides por mililitro sen producir efectos adversos. Con todo, como se comentou anteriormente, a inxección semanal reducía a retención ao tratamento. Ademais, a pesar do bo tratamento, o número de embarazos foi significativo. Como consecuencia, suspendeuse o proceso de comercialización do medicamento como método anticonceptivo.
Tras o fracaso de tantos proxectos ilusionados e monetarios, as investigacións paráronse. En 2004, con todo, na prestixiosa revista Journal of Clinical Endocrinology and Metabolism, publicáronse os resultados do ensaio realizado polo equipo de investigación do Dr. Gu con 308 homes sans chineses mediante a doazón de testosterona undecanoato (A túa). As inxeccións mensuais da túa de 500 miligramos demostraron altas porcentaxes de eficiencia. Ademais, a diferenza das investigacións apoiadas pola OMS, entre quen mantiveron a espermatogénesis por baixo dos 3 millóns de espermatozoides por mililitro non houbo ningún caso de embarazo. A tolerancia ao tratamento tamén foi moi boa, á marxe das feridas provocadas pola inxección e de certos efectos adversos reversibles de baixo risco (hiperlipidemia, acne, aumento de peso, hiperhemoglobinemia). Con todo, os bos resultados obtidos en China non se conseguiron cos caucásicos; segundo os expertos, ao ser os asiáticos máis sensibles á testosterona, habería que utilizar diferentes doses en función da orixe do individuo. Así, tras varios estudos coa A túa para medir o efecto da diferenza étnica sobre a capacidade anticonceptiva da testosterona, observouse que a azoospermia era superior ao 90% entre os voluntarios asiáticos e ao 60% nos caucásicos. Ademais, non podemos esquecer que a A túa non é efectiva por boca. Por tanto, na procura de métodos anticonceptivos máis universais, abríronse as portas a novas estratexias e, ademais de andrógenos, empezáronse a probar outras hormonas.
Novos tratamentos hormonais
Tendo en conta o anterior, era evidente que a estratexia hormonal debía ir por outro camiño. Por exemplo, paira evitar os inconvenientes da inxección, ensaiáronse tamén con implantes de testosterona baixo a pel ou con chapatas e xeles de testosterona sobre a pel. Con todo, nas terapias baseadas nun só andrógeno, hanse de dar altas doses e déronse conta das dificultades que tiñan paira controlar a perda de libido e masa muscular. Por iso recorreuse á procura de combinacións hormonais.
Entre as hormonas candidatas paira combinar con testosterona atópanse as progestinas e os antagonistas do GnRH. Estes inhiben a espermatogenesis evitando a secreción de hipofisarias FSH e LH. Os antagonistas do GnRH son fármacos de gran potencia capaces de inhibir a espermatogenesis a doses inferiores ás progestinas. Con todo, son moi caros e, dado que o corpo metaboliza rapidamente, deben inxectarse con moita frecuencia. Así, a aposta dos investigadores baseouse nas combinacións entre progestinas e testosterona.
Quizá os sistemas depot baseados na combinación de testosterona e progestinas son a mellor opción en todos eles. Turner e os seus colaboradores experimentaron en 2003 en 55 homes sans o sistema depot do acetato de medroxiprogesterona (hormona da familia das progestinas) e a testosterona. Con este método, situando baixo a pel o depósito que controla a liberación da testosterona cada 4 ou 6 meses, superáronse os impedimentos que até entón se produciron na administración da testosterona. A medroxiprogesterona administrábase mensualmente mediante inxección. Con todo, paira garantir a total eficacia e seguridade dos sistemas depot, as investigacións realizadas non son suficientes.
Actualmente avánzase na procura de novos fármacos paira combinar tanto con testosterona como con progestinas. Entre eles, os moduladores selectivos (AHMS) paira o receptor de andrógenos foron os que obtiveron maiores resultados. Do mesmo xeito que a testosterona, os AMHS son andrógenos, pero a súa principal vantaxe respecto da testosterona é a selectividade. É dicir, a testosterona actúa sobre moitas células do corpo e os seus efectos son moi xerais, por exemplo, pode provocar a destrución de células musculares. Os AHMS, pola contra, só actúan sobre células con receptor de andrógenos e non se producen perdas de libido nin de masa muscular. Os AHMS son activos por vía oral e nos coellos demostrouse que inhiben eficazmente a espermatogenesis sen a axuda doutros fármacos. Con todo, aínda se atopan en fase preclínica e non sabemos si en humanos vanse a obter resultados como nos coellos.
Desde os anos 60 até o XXI. Una vez analizada a evolución até principios do século XX, os expertos demostraron que será difícil conseguir un tratamento oral adecuado con terapia hormonal. Por iso, desde 2004 están a investigarse terapias de maior especificidad baseadas en tratamento non hormonal.
Tratamentos non hormonais
En comparación cos tratamentos hormonais, o non hormonais, ademais de ser capaces de influír na espermatogenesis, tamén son capaces de inhibir a función dos espermatozoides. No tratamento non hormonal utilízanse fármacos destinados a unha molécula específica dos testículos ou da estrutura do espermatozoide. Os investigadores creen que isto evitará a perda de libido e masa muscular que aparecen con terapia hormonal. Con todo, existen certas barreiras paira o desenvolvemento dun fármaco non hormonal adecuado. Entre outras cousas, o fármaco debe poder atravesar a barreira do sangue aos testículos.
Coñécense moitos fármacos non hormonais que, a pesar de mostrar resultados preclínicamente moi interesantes, non evolucionaron por barreiras. Por exemplo, nos monos, a indenopiridina administrada por boca durante 7 días interrompe a produción de espermatozoides paira a Semana 2 sen afectar á concentración de testosterona en sangue. Ademais, a inhibición da espermatogenesis é capaz de mantela durante 6 semanas, recuperándose completamente paira a semana 16. Está demostrado que a lonidamina (fármacos quimioterápicos), a adjuina e o gamendazol, análogo á lonidamina, do mesmo xeito que a indenopiridina, inhiben a espermatogénesis, dificultando a función das células germinales sertoli do testículo. Con todo, estes tres fármacos, ao ter una toxicidade moito maior que a indenopiridina, non avanzaron.

Na actualidade, as moléculas específicas que controlan a función dos espermatozoides son as que máis investigacións están a realizar. En particular, están a buscarse novas estratexias paira reducir a mobilidade dos espermatozoides, investigando paira iso proteínas de diferentes partes do espematozoide. Por exemplo, demostraron que se reduce a mobilidade influíndo nas canles catiónicos CatSpers da cola dos espermatozoides dos ratos. Así mesmo, están a estudarse algunhas proteínas de membrana celular, entre as que as máis estudadas son a encima adenilil ciclasa e o sustituyente Na + /K +. Con todo, os resultados dos ensaios en animais seguen sendo limitados, e serán necesarios uns anos paira medir o papel concreto destas proteínas nos espermatozoides humanos e coñecer a eficacia e toxicidade destes novos fármacos.
En definitiva, a pesar de que as investigacións de estratexias non hormonais atópanse moito máis atrasadas, cabe destacar que deben terse moi en conta paira evitar os inconvenientes dos tratamentos hormonais. No entanto, para que a vontade fágase realidade, o interese das empresas farmacéuticas será fundamental.





