Embarazo en manos de hombres
Farmazian doktorea. Biofarmazia, Farmakozinetika eta Farmazia-teknologiako irakasle kolaboratzailea
Farmazia Fakultatea UPV-EHU, Vitoria-Gasteiz
Farmazian doktorea. Biofarmazia, Farmakozinetika eta Farmazia-teknologiako irakasle kolaboratzailea
Farmazia Fakultatea UPV-EHU, Vitoria-Gasteiz

La función de los científicos es hacer preguntas a la naturaleza e interpretar y poner en práctica sus respuestas. Siguiendo con el postulado, tomando como base los cambios hormonales que sufre la mujer durante el embarazo, se descubrió que las hormonas externalizadas inhibían la ovulación y se lanzaron en 1960 los primeros anticonceptivos hormonales para las mujeres. Tras conocer el éxito de la terapia hormonal en las mujeres, era de esperar que se probara lo antes posible en los hombres. Sin embargo, sobre todo por motivos socioculturales, se han tardado tres décadas en iniciar investigaciones con mayor seriedad sobre métodos anticonceptivos masculinos.
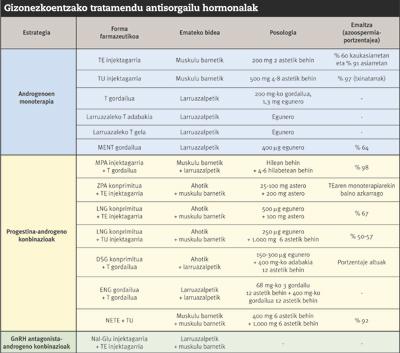
En la búsqueda de anticonceptivos masculinos, ante la capacidad de reducir la producción de espermatozoides (espermatogenesis), se dieron los primeros pasos con testosterona. Los estudios realizados con testosterona tienen una evolución cercana a los 40 años. En primer lugar, en los años 70 se intentó determinar el tipo y dosis de testosterona más adecuadas para inhibir la espermatogenesis. 20 años después, al amparo de la Organización Mundial de la Salud (OMS), se realizaron los dos primeros estudios multinacionales para medir la capacidad anticonceptiva de la testosterona. Sin embargo, por diversas razones, los resultados nunca han sido muy satisfactorios. Por un lado, la testosterona, que por vía oral produce una degradación hepática por inyección. Por otro lado, porque produce efectos secundarios importantes, como la testosterona produce la pérdida de libido y masa muscular. Además, desde el inicio del tratamiento hasta la efectiva inhibición de la espermatogénesis es un tiempo largo (8-10 semanas).
A modo de ejemplo, hay que mencionar las investigaciones auspiciadas por la OMS en la década de los 90, que fueron un hito para los siguientes. En estas investigaciones, un total de 670 individuos sanos administrados por vía intramuscular el enantato de testosterona (TE) una vez a la semana, se demostró que era posible mantener la espermatogenesis por debajo de los 3 millones de espermatozoides por mililitro sin producir efectos adversos. Sin embargo, como se ha comentado anteriormente, la inyección semanal reducía la retención al tratamiento. Además, a pesar del buen tratamiento, el número de embarazos fue significativo. Como consecuencia, se suspendió el proceso de comercialización del medicamento como método anticonceptivo.
Tras el fracaso de tantos proyectos ilusionados y monetarios, las investigaciones se pararon. En 2004, sin embargo, en la prestigiosa revista Journal of Clinical Endocrinology and Metabolism, se publicaron los resultados del ensayo realizado por el equipo de investigación del Dr. Gu con 308 hombres sanos chinos mediante la donación de testosterona undecanoato (TU). Las inyecciones mensuales de TU de 500 miligramos demostraron altos porcentajes de eficiencia. Además, a diferencia de las investigaciones apoyadas por la OMS, entre quienes mantuvieron la espermatogénesis por debajo de los 3 millones de espermatozoides por mililitro no hubo ningún caso de embarazo. La tolerancia al tratamiento también fue muy buena, al margen de las heridas provocadas por la inyección y de ciertos efectos adversos reversibles de bajo riesgo (hiperlipidemia, acné, aumento de peso, hiperhemoglobinemia). Sin embargo, los buenos resultados obtenidos en China no se consiguieron con los caucásicos; según los expertos, al ser los asiáticos más sensibles a la testosterona, habría que utilizar diferentes dosis en función del origen del individuo. Así, tras varios estudios con la TU para medir el efecto de la diferencia étnica sobre la capacidad anticonceptiva de la testosterona, se observó que la azoospermia era superior al 90% entre los voluntarios asiáticos y al 60% en los caucásicos. Además, no podemos olvidar que la TU no es efectiva por boca. Por tanto, en la búsqueda de métodos anticonceptivos más universales, se abrieron las puertas a nuevas estrategias y, además de andrógenos, se empezaron a probar otras hormonas.
Nuevos tratamientos hormonales
Teniendo en cuenta lo anterior, era evidente que la estrategia hormonal debía ir por otro camino. Por ejemplo, para evitar los inconvenientes de la inyección, se ensayaron también con implantes de testosterona bajo la piel o con chapatas y geles de testosterona sobre la piel. Sin embargo, en las terapias basadas en un solo andrógeno, se han de dar altas dosis y se han dado cuenta de las dificultades que tenían para controlar la pérdida de libido y masa muscular. Por ello se recurrió a la búsqueda de combinaciones hormonales.
Entre las hormonas candidatas para combinar con testosterona se encuentran las progestinas y los antagonistas del GnRH. Estos inhiben la espermatogenesis evitando la secreción de hipofisarias FSH y LH. Los antagonistas del GnRH son fármacos de gran potencia capaces de inhibir la espermatogenesis a dosis inferiores a las progestinas. Sin embargo, son muy caros y, dado que el cuerpo metaboliza rápidamente, deben inyectarse con mucha frecuencia. Así, la apuesta de los investigadores se basó en las combinaciones entre progestinas y testosterona.
Quizá los sistemas depot basados en la combinación de testosterona y progestinas son la mejor opción en todos ellos. Turner y sus colaboradores experimentaron en 2003 en 55 hombres sanos el sistema depot del acetato de medroxiprogesterona (hormona de la familia de las progestinas) y la testosterona. Con este método, situando bajo la piel el depósito que controla la liberación de la testosterona cada 4 o 6 meses, se superaron los impedimentos que hasta entonces se habían producido en la administración de la testosterona. La medroxiprogesterona se administraba mensualmente mediante inyección. Sin embargo, para garantizar la total eficacia y seguridad de los sistemas depot, las investigaciones realizadas no son suficientes.
Actualmente se avanza en la búsqueda de nuevos fármacos para combinar tanto con testosterona como con progestinas. Entre ellos, los moduladores selectivos (AHMS) para el receptor de andrógenos han sido los que han obtenido mayores resultados. Al igual que la testosterona, los AMHS son andrógenos, pero su principal ventaja respecto a la testosterona es la selectividad. Es decir, la testosterona actúa sobre muchas células del cuerpo y sus efectos son muy generales, por ejemplo, puede provocar la destrucción de células musculares. Los AHMS, por el contrario, sólo actúan sobre células con receptor de andrógenos y no se producen pérdidas de libido ni de masa muscular. Los AHMS son activos por vía oral y en los conejos se ha demostrado que inhiben eficazmente la espermatogenesis sin la ayuda de otros fármacos. Sin embargo, todavía se encuentran en fase preclínica y no sabemos si en humanos se van a obtener resultados como en los conejos.
Desde los años 60 hasta el XXI. Una vez analizada la evolución hasta principios del siglo XX, los expertos han demostrado que será difícil conseguir un tratamiento oral adecuado con terapia hormonal. Por ello, desde 2004 se están investigando terapias de mayor especificidad basadas en tratamiento no hormonal.
Tratamientos no hormonales
En comparación con los tratamientos hormonales, los no hormonales, además de ser capaces de influir en la espermatogenesis, también son capaces de inhibir la función de los espermatozoides. En el tratamiento no hormonal se utilizan fármacos destinados a una molécula específica de los testículos o de la estructura del espermatozoide. Los investigadores creen que esto evitará la pérdida de libido y masa muscular que aparecen con terapia hormonal. Sin embargo, existen ciertas barreras para el desarrollo de un fármaco no hormonal adecuado. Entre otras cosas, el fármaco debe poder atravesar la barrera de la sangre a los testículos.
Se conocen muchos fármacos no hormonales que, a pesar de mostrar resultados preclínicamente muy interesantes, no han evolucionado por barreras. Por ejemplo, en los monos, la indenopiridina administrada por boca durante 7 días interrumpe la producción de espermatozoides para la Semana 2 sin afectar a la concentración de testosterona en sangre. Además, la inhibición de la espermatogenesis es capaz de mantenerla durante 6 semanas, recuperándose completamente para la semana 16. Está demostrado que la lonidamina (fármacos quimioterápicos), la adjuina y el gamendazol, análogo a la lonidamina, al igual que la indenopiridina, inhiben la espermatogénesis, dificultando la función de las células germinales sertoli del testículo. Sin embargo, estos tres fármacos, al tener una toxicidad mucho mayor que la indenopiridina, no han avanzado.

En la actualidad, las moléculas específicas que controlan la función de los espermatozoides son las que más investigaciones están realizando. En particular, se están buscando nuevas estrategias para reducir la movilidad de los espermatozoides, investigando para ello proteínas de diferentes partes del espematozoide. Por ejemplo, han demostrado que se reduce la movilidad influyendo en los canales catiónicos CatSpers de la cola de los espermatozoides de los ratones. Asimismo, se están estudiando algunas proteínas de membrana celular, entre las que las más estudiadas son la enzima adenilil ciclasa y el sustituyente Na + /K +. Sin embargo, los resultados de los ensayos en animales siguen siendo limitados, y serán necesarios unos años para medir el papel concreto de estas proteínas en los espermatozoides humanos y conocer la eficacia y toxicidad de estos nuevos fármacos.
En definitiva, a pesar de que las investigaciones de estrategias no hormonales se encuentran mucho más retrasadas, cabe destacar que deben tenerse muy en cuenta para evitar los inconvenientes de los tratamientos hormonales. No obstante, para que la voluntad se haga realidad, el interés de las empresas farmacéuticas será fundamental.





