Maquinària per a la prevenció de malalties neurodegeneratives
Plegat de proteïnes i chapperones moleculars
Les proteïnes són components bàsics de la vida, ja que garanteixen el funcionament de les cèl·lules. Aquestes molècules, formades per un petit alfabet de vint aminoàcids, s'ocupen com a màxim de les funcions que tenen lloc en la cèl·lula, des de reaccions químiques fins a funcions estructurals. La col·lecció de proteïnes –proteoma– que hi ha en un organisme en un moment donat és molt variable i gairebé infinita, encara que tota la informació per a construir la col·lecció està codificada en els gens.
El dogma principal de la biologia molecular explica la transferència d'informació de l'ADN a les proteïnes, sent l'ARN mediador. L'expressió dels gens s'inicia a partir de la transcripció, on, a partir de la doble molècula d'ADN, es produeix la cadena auxiliar d'ARN, que serà una còpia d'aquesta informació genètica concreta. En el segon pas, l'ARN missatger torna a la maquinària denominada ribosoma, obtenint la proteïna. La proteïna recentment sintetitzada haurà d'assimilar una estructura tridimensional adequada per a ser funcionalment activa, però en les cèl·lules aquest procés no sempre és espontani.
Els chaperones moleculars són essencials en les cèl·lules, ja que s'encarreguen del control de qualitat de les proteïnes, garantint així l'homeòstasi de les proteinas2. I és que moltes proteïnes necessiten l'ajuda dels txaperones per a aconseguir la seva estructura nativ3. Sense la seva ajuda poden produir-se problemes en el procés de plegat de la proteïna i formar intermediaris mal plegats. Aquests intermediaris afloraran les zones adhesives que haurien d'estar en el nucli de la proteïna i tendiran a la seva agregación4. A més, l'agregació d'una mena de proteïnes pot influir en l'agregació d'altres espècies de proteïnes, permetent el que es coneix com coagregación.
El procés de plegat de proteïnes recentment sintetitzades no és l'única via per a generar els primers intermediaris dels àrids. De fet, les proteïnes que ja posseeixen una estructura tridimensional adequada (estructura nativa) també poden sofrir destolaciones i formar intermediaris reactius. Les principals causes d'aquesta desestabilització estan relacionades amb mutacions o estrès cel·lular, que és major en els majors, ja que els mecanismes d'homeòstasis de les proteïnes són més obsolets.
De fet, en una situació normal, davant qualsevol estrès cel·lular, els chaperones moleculars el perceben i responen ràpidament, mantenint així l'homeòstasi de les proteïnes. No obstant això, quan es van imposant o es cronifican situacions d'estrès, com les mutacions, és més difícil garantir la qualitat de les proteïnes de les celulas6. En aquestes circumstàncies, la presència de txaperones moleculars és menor per a fer front als problemes de flexió de les proteïnes (a causa de la seva menor expressió o a la saturació del sistema per contrarestar l'estrès cel·lular), augmentant la quantitat de proteïnes danyades i malament plegadas7.
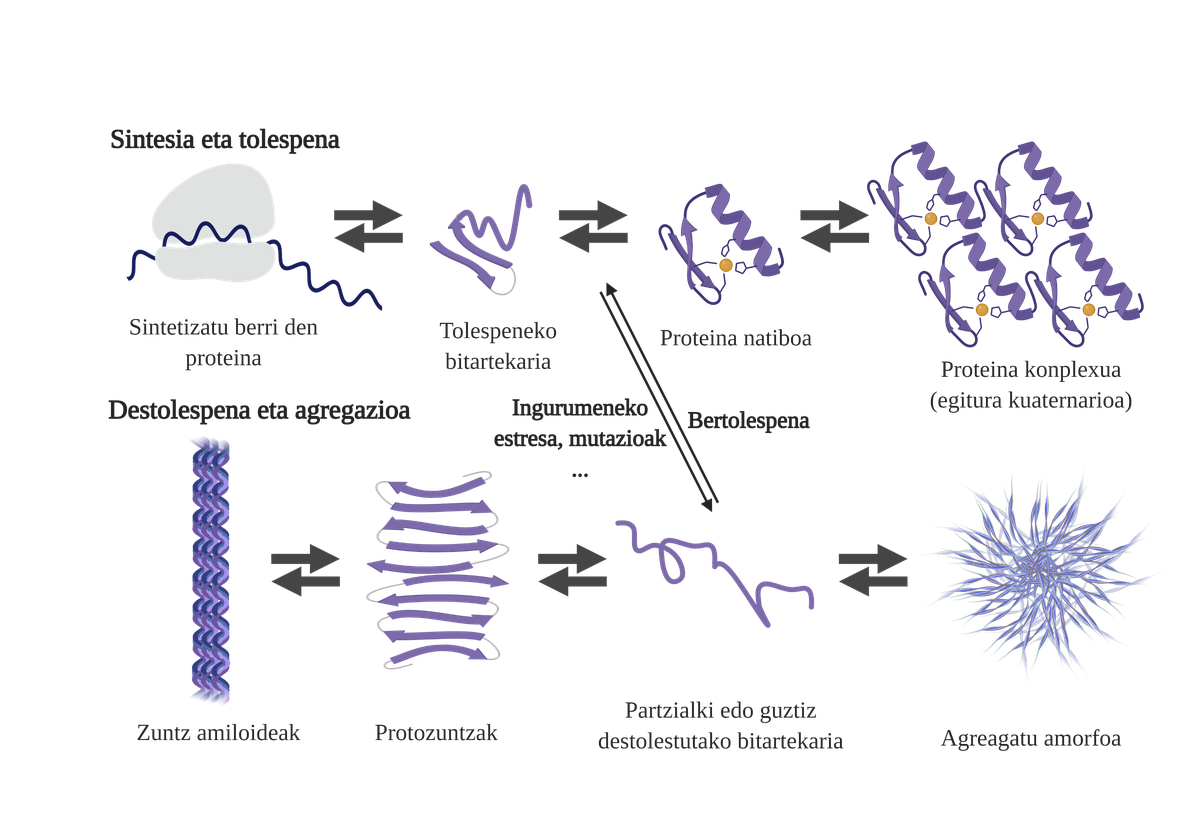
L'agregació dificulta el funcionament cel·lular i provoca l'aparició de malalties relacionades amb la flexió de proteïnes com l'alzheimer, el parkinson o altres malalties neurodegenerativas8. De fet, diverses malalties neurodegeneratives presenten una característica comuna: l'acumulació de proteïnes agregades d'estructura amiloide presents en el cervell.
Agregació i efectes dels àrids
Els processos d'agregació de proteïnes en aquestes malalties són lents i organitzats. En l'actualitat, el model més acceptat per a explicar la formació d'estructures amiloidogénicas és la polimerització en nucleación. Segons ell, el procés d'agregació presenta una cinètica característica que pot dividir-se en dues fases diferenciades: lag o nuclear i exponencial o d'estirament.
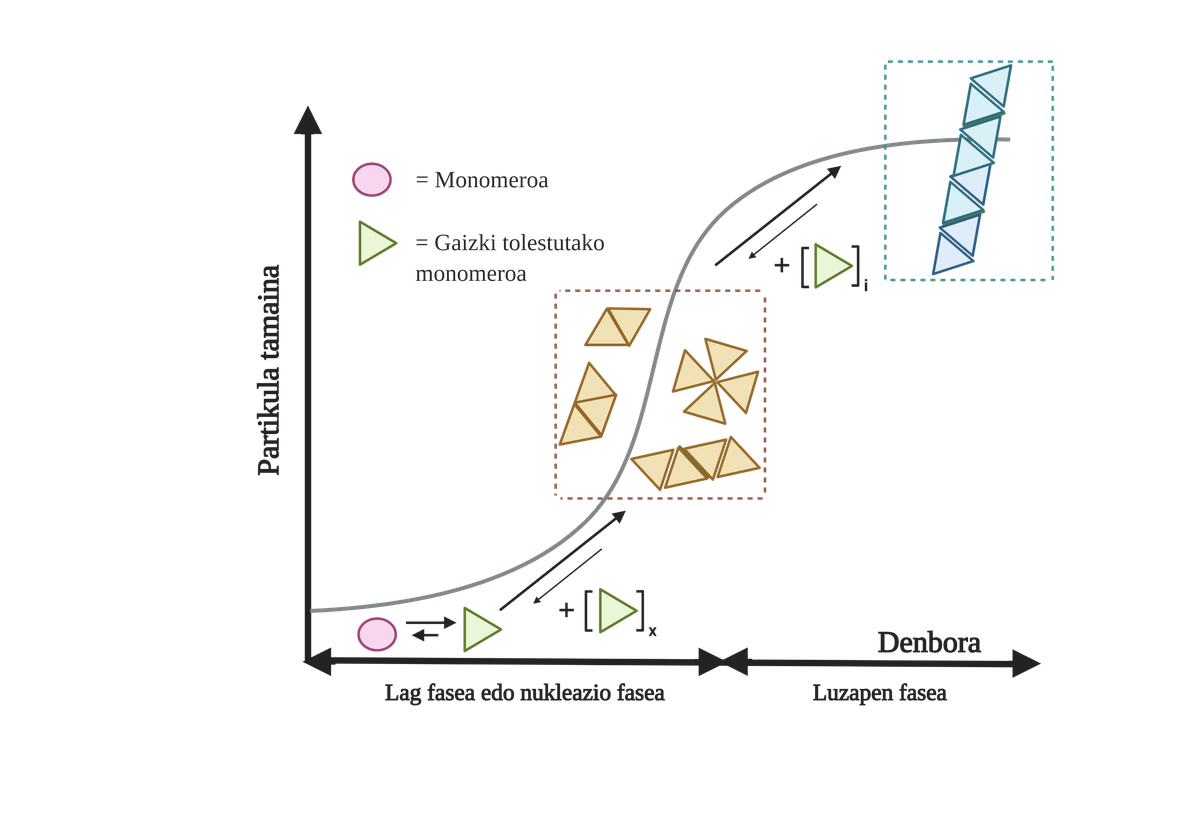
En la fase de Lag es creen els primers intermediaris denominats llavor o nucli, els reactius. En aquestes estructures es formen petits o oligoméricos agregats de proteïnes mal plegades que s'han unit entre si i que comencen la segona fase. Aquests petits agregats o oligómeros acumulats en fase exponencial atreuen més proteïnes formant agregats cada vegada més grans fins a formar fibres amiloides 10.
En l'actualitat no està del tot clar quin és el paper dels àrids, però sembla que els intermediaris de l'agregació són els més tòxics per a la cèl·lula. Segons aquesta hipòtesi, el procés d'agregació seria, per tant, un mètode de protecció cel·lular enfront d'intermediaris tòxics. En qualsevol cas, se sap que les acumulacions d'espècies amiloides són tòxiques i que la seva acumulació produeix una apoptosi neuronal o mort cel·lular programada en el cervell.
La mort natural, precisa i programada de les neurones, l'apoptosi neuronal, és un procés imprescindible per a la maduració del sistema nerviós central. No obstant això, una vegada que el sistema nerviós central estigui ben desenvolupat, la majoria de les neurones adultes es mantindran al llarg de tota la vida de l'organisme, ja que la taxa d'apoptosi de les neurones és molt baixa. L'apoptosi precoç de les neurones o l'apoptosi aberrant mal regulada provoca l'aparició de malalties neurodegeneratives. Tenint en compte en quina zona del cervell es produeix l'acumulació d'espècies amiloidogénicas i la consegüent apoptosi de les neurones, es desenvoluparà una malaltia neodegenerativa diferent. Per exemple, la pèrdua de neurones de l'hipocamp està relacionada amb l'alzheimer, mentre que la disminució de neurones dopaminérgicas en el negre de substància està relacionada amb el parkinson 14.
El paper dels txaperones moleculars davant els intermediaris tòxics
A més de contribuir al procés de plegat de proteïnes recentment sintetitzades, els txaperones moleculars també participen en la replegación d'intermediaris mal plegats, permetent la desaparició d'intermediaris reactius. Per tant, els txaperones moleculars ajuden tant en la prevenció com en la replegación, evitant la formació d'intermediaris tòxics o garantint l'alliberament i virilización de proteïnes presents en els oligómeros quan la formació d'intermediaris és inevitable.
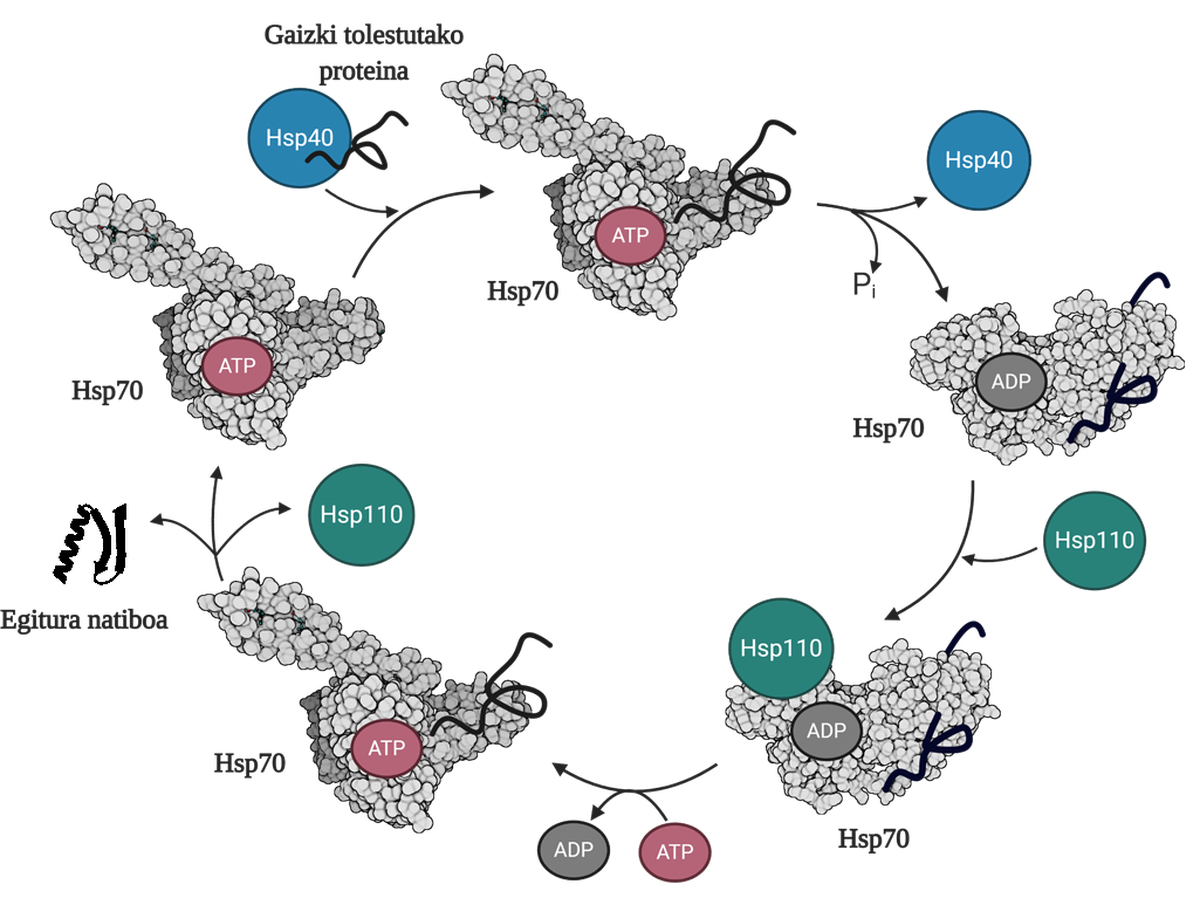
Per a permetre la regeneració de proteïnes mal plegades o agregades és necessari coordinar tres famílies de chapperones moleculars: Hsp70, Hsp40 i Hsp110. Entre els tres formen el sistema Hsp70, que, utilitzant l'energia mecànica alliberada de la hidròlisi de l'ATP, permet a les proteïnes mal doblegades obtenir una estructura nativa gràcies al procés denominat cicle de l'ATP (Figura 3). La proteïna Hsp70 consta de dos dominis: el domini d'unió del nucleòtid (NBD), en el qual tindrem nucleòtids ATP o ADP, i el domini d'unió del substrat (SBD), que depenent del nucleòtid associat al NBD, estarà en conformat obert o tancat.
La proteïna Hsp40 afectarà un mediador mal plegat i transferirà al chaperón Hsp70 que està unit a l'ATP, el domini de la qual SBD estarà en conformació oberta en presència de l'ATP. Per estimulació del substrat i de la proteïna Hsp40, l'Hsp70 hidròlisi de l'ATP, quedant l'ADP subjecte a l'Hsp70. En aquesta situació, l'Hsp40a s'alliberarà del complex i el substrat quedarà atrapat en el SBD de l'Hsp70, ja que en presència de l'ADP aquest domini adquirirà una conformació tancada. En aquest moment, el cicle inclourà l'Hsp110 o el bescanviador de nucleòtids (NEF) i intercanviarà l'ADP que conté l'Hsp70 amb un nou ATP. A causa de la presència de l'ATP, el SBD tornarà a passar al conformat obert i alliberarà el substrat al mitjà. D'aquesta forma, el substrat tindrà una altra possibilitat de plegar-se bé, normalment serà capaç d'obtenir una estructura nativa i la proteïna Hsp70 serà reciclada per a un pròxim cicle 10.
La funció de desagregació/replegat del sistema Hsp70 és, per tant, imprescindible per a evitar l'acumulació d'intermediaris tòxics, ja que a més d'evitar la generació d'aquests tòxics, és capaç de dur a terme la desagregació d'oligómeros ja constituïts. El funcionament eficient d'aquest sistema comporta la capacitat de prevenir malalties relacionades amb problemes de plegament com el parkinson, l'alzheimer o l'esclerosi lateral amiotròfica.
Càncer i apoptosi
Una de les principals característiques del càncer és la immortalitat de les cèl·lules canceroses. La ràpida divisió de les cèl·lules canceroses i la resistència a l'apoptosi són els principals responsables de l'augment del tumor. Les cèl·lules cancerígenes utilitzen diferents vies per a evitar l'apoptosi, principalment inhibició dels senyals pro-apoptóticas i augment dels estímuls anti-apoptóticos. D'aquesta forma aconsegueixen mantenir les cèl·lules tumorals, malgrat sofrir un elevat estrès, sense entrar en l'apoptosi. Sent el sistema Hsp70 un mecanisme anti-estrès, en les cèl·lules cancerígenes és molt freqüent la sobreexpresión del chaperón Hsp70, la qual cosa afavoreix la resistència a l'apoptosión16.
El sistema Hsp70 com a diana terapèutica al càncer
Donada la importància que té l'Hsp70 en les cèl·lules tumorals, sembla que pot ser una diana terapèutica adequada per a reduir la resistència de les cèl·lules cancerígenes als fàrmacs i per tant disminuir els tumors 17. Hi ha estudis que demostren que la disminució de l'expressió de l'Hsp70 és tòxica en les cèl·lules cancerígenes, però no és evident en les cèl·lules no modificadas18. La inhibició de l'Hsp70 afecta més a les cèl·lules tumorals, que tindran prioritat de mort respecte a les cèl·lules normals. De fet, el fenotip (constantment estressat) de la cèl·lula tumoral depèn de la funció protectora de l'Hsp70 per a combatre la citotoxicitat i per tant evitar l'apopto19. Hrrn ha ampliat notablement el camp de recerca del sistema Hsp70; l'ús del chaperón Hsp70 com a diana té un gran futur, ja que pot ser útil no sols per al tractament de malalties neurodegeneratives, sinó també per a tractaments de càncer..
Referències
1- Crick F. 1970. “Central Dogma of Molecular Biology.” Nature, 227(5258): 561–63.
2- Fi B, Weissman, J. i Horwich, A. 2006. “Molecular Chaperones and Protein Quality Control.” Cell, 125(3): 443–51.
3- Gao X, Carroni M. Nussbaum-Krammer C, Mogk A., Nillegoda n. b., Szlachcic A. Guilbride D.L. H.R. Saibil, Mayer M.P. i B. Final. 2015 “Human Hsp70 Disaggregase Reverses Parkinson’s-Linked ?-Synuclein Amyloid Fibrils.” Molecular Cell, 59(5): 781–93.
4- O.T.E. 1996. “Molecular Chaperones in Cellular Protein Folding.” Nature, 381(6583): 571–79.
5- Morimoto R.I. 2008. “Proteotoxic stress and inducible chaperone networks in neurodegenerative disease and aging.” Gens & Developement, 22(11): 1427–1438.
6- Radwan M., Wood R.J. Sui X, i Hatters D.M. 2017 “When proteostasis goes bad: protein aggregation in the cell.” IUBMB Life, 69, 49–54.7
7- Stroo E., Koopman M., O.A.F. Nollen i Mata-Cabana A. 2017 “Cellular Regulation of Amyloid Formation in Aging and Disease.” Forntiers in Neuroscience, 11: 64.
8- Stetler R.A., I., Zhang W., C. O. Liou, I. Gao, Cao G. i Chen J. 2010 “Heat Xoc Proteins: Cellular and Molecular Mechanisms in the Central Nervous System.” Progress in Neurobiology, 92(2): 184–211.
9- GoM. i Spillantini M.G. 2006. “A century of Alzheimer’s disease.” Science, 314, 777–781.
10- Chaari A. 2019. “Molecular chaperones biochemistry and role in neurodegenerative diseases.” International Journal of Biological Macromolecules, 131:396-411.
11- Hartl F.O., i Hayer-Hartl M. 2009. “Converging concepts of protein folding in vitro and in vivo.” Nature Structural and Molecular Biology, 16, 574–581.
12- Awasthi A., Matsunaga I i Yamada T. 2005 “Amyloid-beta causis apoptosi of neuronal cells via caspase cascade, which ca be prevented by amyloid-beta-derived short peptides.” Experimental Neurology, 196(2): 282-289.
13- Okouchi M, Ekshyyan O., Maracine M. i Aw T.I. 2007 “Neuronal Apoptosi in Neurodegeneration.” Antioxidants & Redox Signaling, 9(8): 1059-1096.
14- Chi H., Chang H.I i Sang T.K. 2018. “Neuronal Cell Death Mechanisms in Major Neurodegenerative Diseases.” International Journal of Molecular Sciences, 19(10): 3082.
15- Hanahan D. i Weinberg R.A. 2000. “The Hallmarks of Cancer.” Cell, 100(1): 57-70.
16- D. Brusa, C. Migliore, Garetto S., Simone M. i Matera L. 2009. “Inmunogenicity of 56 degrees C and uvc-treated prostate cancer is associated with release of HSP70 and HMGB1 from necrotic cells.” Prostate, 69: 1343–1352.
17- S. Gurbuxani, Bruey J.M. Fromentin A., C. Larmonier, Parcellier A., Jaattel M., Martín F., Solary E. i Garrido C. 2001. “Selective depletion of inducible HSP70 enhances inmunogenicity of rat còlon cancer cells.” Oncogene, 20: 7478–7485.
18- Garrido C., Schmitt E., Tanqui amb clau C., Vahsen N., Parcellier A. i Kroemer G. 2003. “HSP27 and HSP70: potentially oncogenic apoptosi inhibitors.” Cell Cycle, 2: 579–584.
19- Kumar S., J. Strokes, Singh O.P., S.G. Gunn, Acharya A., Manne O. i Mishra M. 2016 “Target Hsp70: A possible therapy for cancer.” Cancer Letters, 374(1): 156-166.