Gaixotasun neurodegeneratiboen prebentziorako makineria
Proteinen tolespena eta txaperoi molekularrak
Proteinak bizitzaren oinarrizko osagaiak dira, zelulen funtzionamendua bermatzen baitute. Hogei aminoazido dituen alfabeto txiki batez osatutako molekula horiek zelulan gertatzen diren eginkizun gehienez arduratzen dira, hasi erreakzio kimikoetatik eta funtzio estrukturaletara arte. Une jakin batean organismo batean dagoen proteina-bilduma —proteoma— oso aldakorra eta ia amaigabea da, nahiz bilduma eraikitzeko informazio guztia geneetan kodifikatuta dagoen.
Biologia molekularraren dogma nagusiak DNAtik proteinetarako informazio-transferentzia azaltzen du, RNA bitartekari izanda1. Geneen adierazpena transkripziotik hasten da, non, DNA molekula bikoitza abiapuntutzat hartuta, RNA kate osagarria ekoizten den, informazio genetiko jakin horren kopia izango dena. Bigarren pausoan, RNA mezularia erribosoma deritzon makinerian itzuliko da, eta proteina lortuko. Sintetizatu berri den proteinak egitura tridimentsional egokia bereganatu beharko du funtzionalki aktiboa izateko, baina zeluletan prozesu hori ez da beti espontaneoa izaten.
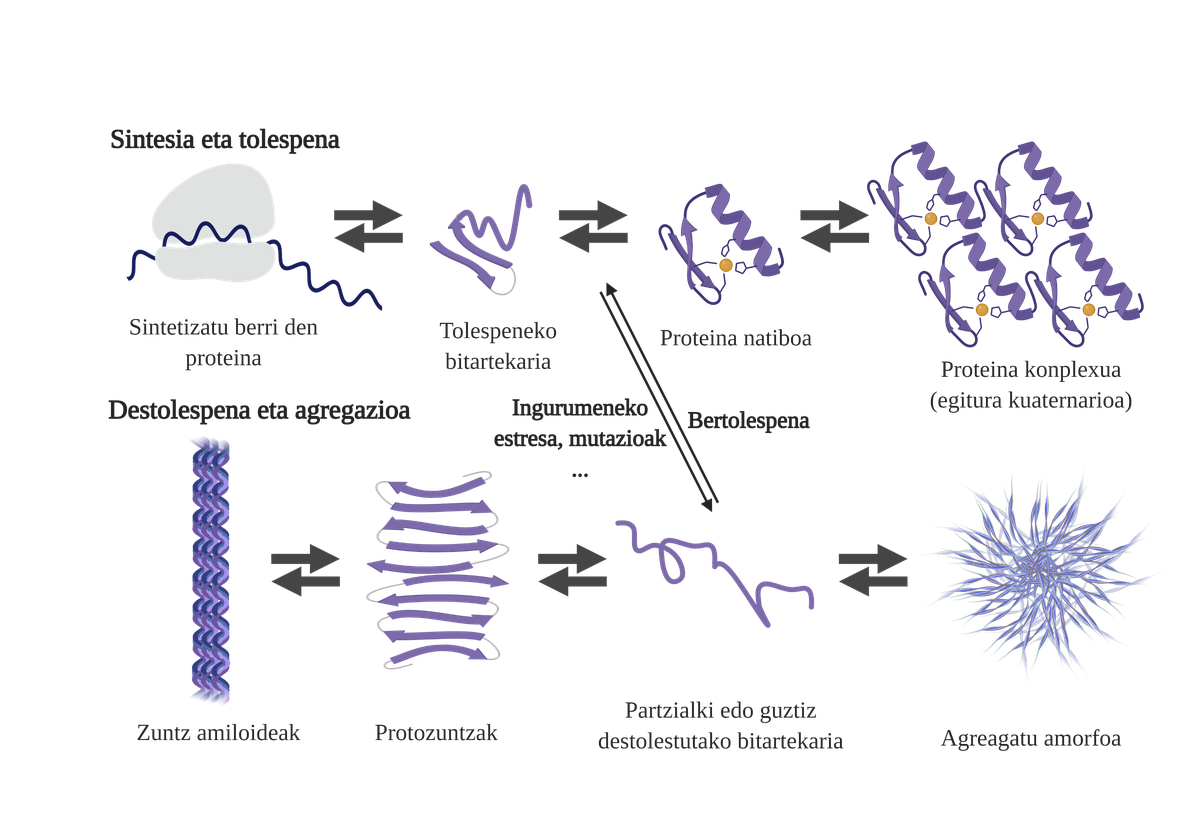
Txaperoi molekularrak ezinbestekoak dira zeluletan, proteinen kalitate-kontrolaz arduratzen baitira eta, hala, proteinen homeostasia bermatzen baitute2. Izan ere, proteina askok txaperoien laguntza behar dute beren egitura natiboa eskuratzeko3. Horien laguntzarik gabe, proteinaren tolespen-prozesuan arazoak gerta daitezke, eta gaizki tolestutako bitartekariak sortu. Bitartekari horiek proteinaren nukleoan egon beharko luketen zonalde itsaskorrak azaleraziko dituzte, eta, hala, beren artean agregatzeko joera izango dute4. Gainera, proteina-mota baten agregazioak beste proteina espezie batzuen agregazioan eragin dezake, eta koagregazio deritzona ahalbidetzen dute horrela.
Sintetizatu berri diren proteinen tolespen-prozesua ez da agregatuen lehenengo bitartekariak sortzeko bide bakarra. Izan ere, jadanik egitura tridimentsional egokia (estruktura natiboa) duten proteinek ere destolespena jasan dezakete, eta bitartekari erreaktiboak eratu. Desestabilizazio horren arrazoi nagusiak mutazioekin edo estres zelularrarekin lotuta egoten dira; estres hori handiagoa da adinduetan, proteinen homeostasirako mekanismoak zaharkituagoak baitaude5.
Izan ere, egoera arrunt batean, edozein estres zelularren aurrean, txaperoi molekularrek azkar sumatu eta erantzuten dute, eta, hala, proteinen homeostasia mantentzen. Hala ere, nagusitu ahala edo estres egoerak kronifikatzen direnean (mutazioak direla medio, adibidez), zailagoa da zeluletako proteinen kalitatea bermatzea6. Egoera horietan txaperoi molekular gutxiago egoten dira proteinen tolespen-arazoei aurre egiteko (gutxiago espresatzen direlako edo sistema saturatuta dagoelako, estres zelularrari aurre egitearen ondorioz), eta, beraz, handitu egiten da kalteturiko eta gaizki tolestutako proteina-kantitatea7.
Agregazioak oztopoak eragiten ditu zelulen funtzionamenduan eta proteinen tolespenarekin zerikusia duten gaixotasunen sorrera dakarte, hala nola alzheimerraren, parkinsonaren edo beste gaixotasun neurodegeneratibo batzuen sorrera8. Izan ere, hainbat gaixotasun neurodegeneratibok ezaugarri nagusi bera dute: garunean agertzen diren egitura amiloideko proteina agregatuen pilaketa9.
Agregazioa eta agregatuen ondorioak
Gaixotasun hauetan gertatzen diren proteinen agregazio-prozesuak motelak eta antolatuak izaten dira. Gaur egun, egitura amiloidogenikoen eraketa azaltzeko eredurik onartuena nukleazio-polimerizazioa da. Beraren arabera, agregazio-prozesuak zinetika bereizgarri bat du, bi fase desberdinetan bana daitekeena: lag fasea edo nukleazio-fasea eta fase esponentziala edo luzapen-fasea.
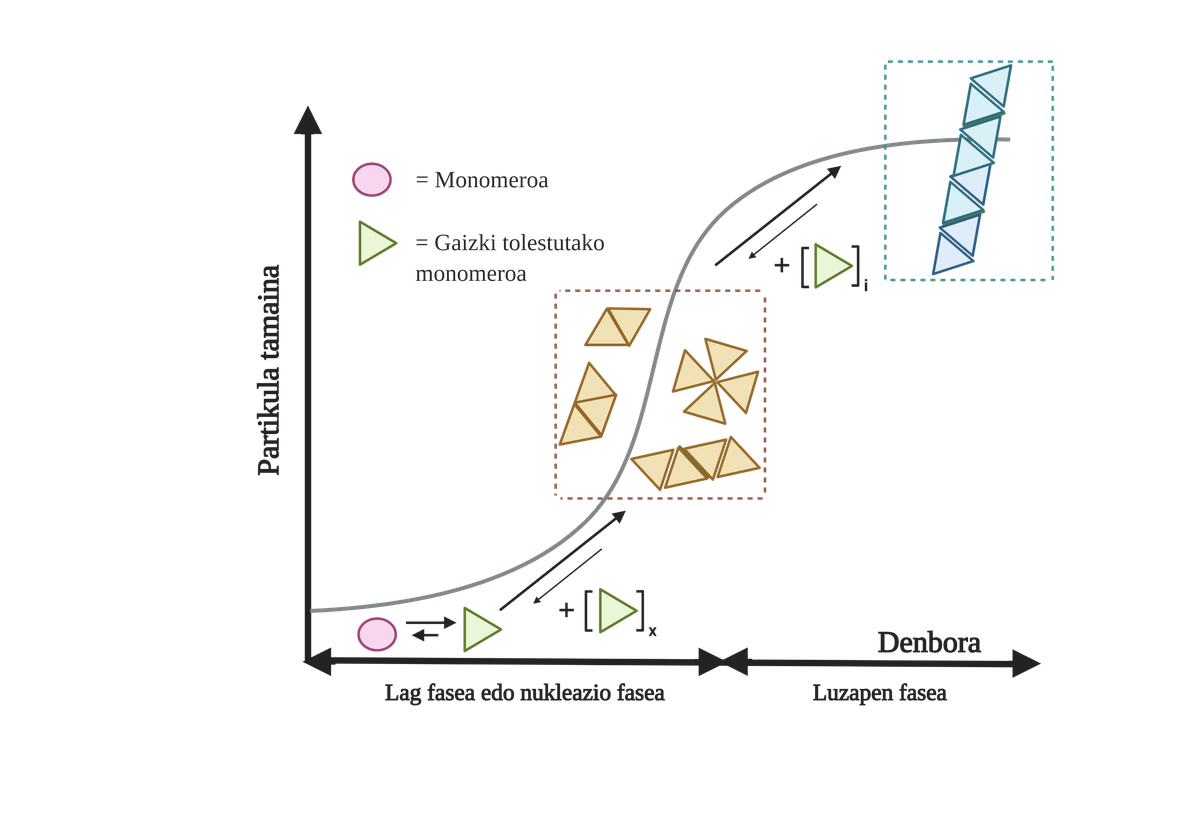
Lag fasean, hazi edo nukleo deritzen lehenengo bitartekariak sortzen dira, bitartekari erreaktiboak alegia. Egitura horietan, haien artean elkartu diren proteina gaizki tolestuen agregatu txiki edo oligomerikoak sortzen dira, eta bigarren fasea hasten. Fase esponentzialean pilatutako agregatu txiki edo oligomero horiek proteina gehiago erakartzen dituzte, agregatu gero eta handiagoak eratuz, zuntz amiloideak sortu arte 10.
Gaur egun ez dago guztiz argi zein den agregatuen rola, baina badirudi agregazioko bitartekariak direla toxikoenak zelularentzat. Hipotesi horren arabera, beraz, agregazio-prozesua bitartekari toxikoei aurre egiteko zelulen babes-metodoa litzateke 11. Edozein modutan, jakina da espezie amiloideen pilaketak toxikoak direla eta, horien metaketaren ondorioz, neuronen apoptosia edo heriotza zelular programatua gertatzen dela garunean12.
Neuronen heriotza natural, zehatz eta programatua —neuronen apoptosia, alegia—, ezinbesteko prozesua da nerbio-sistema zentralaren heldutasuna lortzeko. Hala ere, behin nerbio-sistema zentrala ondo garatuta dagoenean, neurona heldu gehienak organismoaren bizitza osoan zehar mantenduko dira, neuronen apoptosi-tasa oso baxua baita. Neuronen apoptosi goiztiarrak edo gaizki erregulatutako apoptosi aberranteak gaixotasun neurodegeneratiboen sorrera dakar 13. Kontuan izanik garuneko zein gunetan gertatzen den espezie amiloidogenikoen metaketa eta horren ondoriozko neuronen apoptosia, gaixotasun neodegeneratibo ezberdina garatuko da. Esaterako, hipokanpoko neuronen galera alzheimerrarekin lotuta dago, eta substantzia-beltzeko neurona dopaminergikoen murrizketa, berriz, parkinsonarekin 14.
Txaperoi molekularren rola bitartekari toxikoen aurrean
Sintetizatu berri diren proteinen tolespen-prozesuan laguntzeaz gain, txaperoi molekularrek gaizki tolestutako bitartekarien birtolespenean ere parte hartzen dute, eta, hala, bitartekari erreaktiboen desagerpena ahalbidetze dute. Beraz, txaperoi molekularrek prebentzioan zein birtolespenean laguntzen dute, toxikoak diren bitartekarien sorrera ekidinez edo, bitartekariak sortzea saihetsezina denean, oligomeroetan dauden proteinen askapena eta birtolespena bermatuz 3.
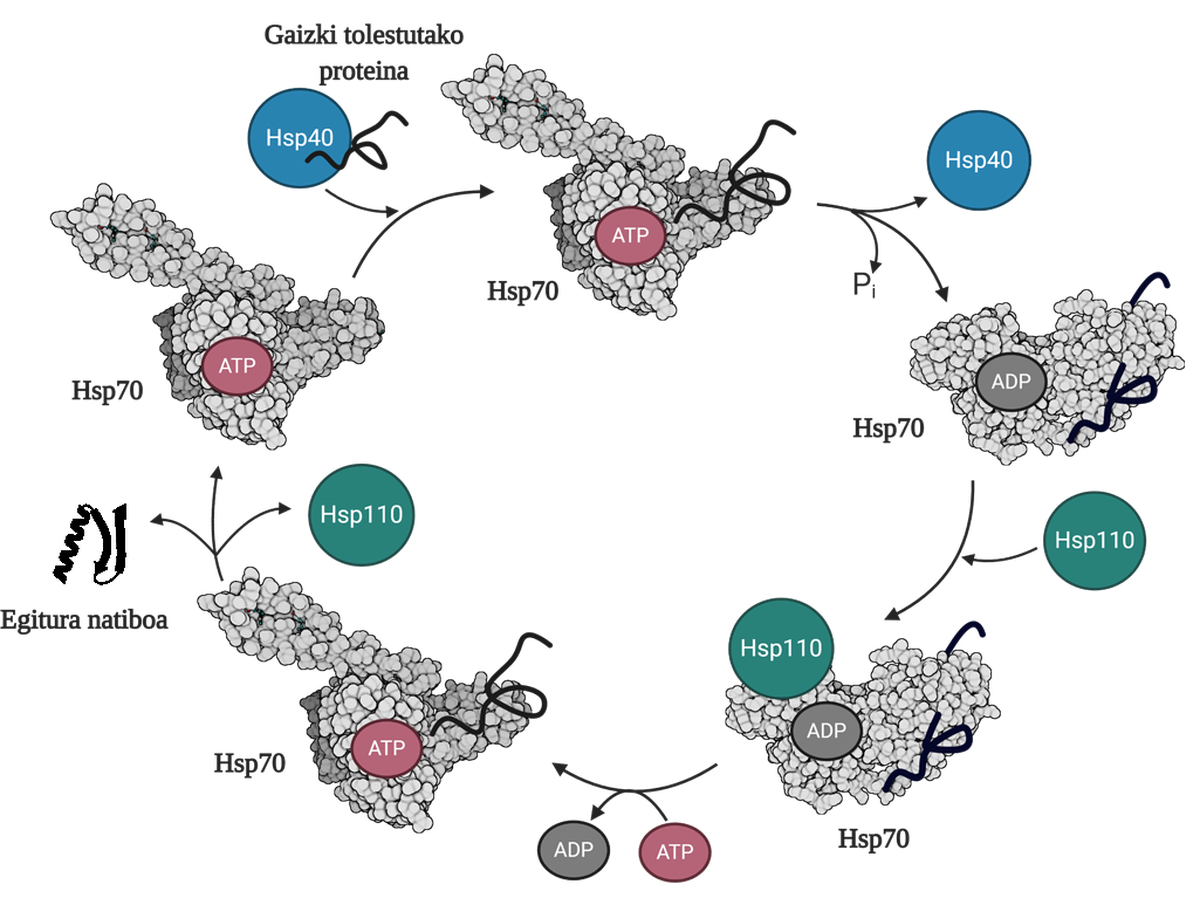
Gaizki tolestutako edo agregatutako proteinen birtolespena ahalbidetzeko, hiru txaperoi molekular familia koordinatu behar dira: Hsp70, Hsp40 eta Hsp110. Hiruren artean Hsp70 sistema osatzen dute, eta horrek, ATParen hidrolisitik askatutako energia mekanikoa erabilita, egitura natiboa eskuratzeko beste aukera bat ematen die gaizki tolestutako proteinei, ATParen ziklo deritzon prozesuari esker (3. irudia). Hsp70 proteinak bi domeinu ditu: nukleotidoa batzeko domeinua (NBD), non ATP edo ADP nukleotidoak izango ditugun, eta substratua batzeko domeinua (SBD), zeina, NBDan lotuta dagoen nukleotidoaren arabera, konformazio irekian edo itxian egongo den.
Hsp40 proteinak gaizki tolestutako bitartekariari eragingo dio, eta ATPari batuta dagoen Hsp70 txaperoiari transferituko dio, azken horren SBD domeinua konformazio irekian egongo baita ATParen presentzian. Substratuaren eta Hsp40 proteinaren estimulazioagatik, Hsp70ak ATParen hidrolisia egingo du, eta ADPa Hsp70ari lotuta geldituko da. Egoera honetan, Hsp40a konplexutik askatuko da, eta substratua Hsp70aren SBDan harrapatuta geldituko, ADParen presentzian domeinu haorrek konformazio itxia hartuko duelako. Une horretan, Hsp110a edo nukleotido-trukatzailea (NEF) sartuko da zikloan, eta Hsp70ak daukan ADPa ATP berri batekin trukatuko du. ATParen presentziaren eraginez, SBDa konformazio irekira pasatuko da berriz, eta substratua mediora askatuko du. Hala, substratuak ondo tolesteko beste aukera bat izango du; normalean, egitura natiboa eskuratzeko gai izango da, eta Hsp70 proteina hurrengo ziklo baterako birziklatuko da 10.
Hsp70 sistemaren desagregazio/birtolespen funtzioa, hortaz, ezinbestekoa da bitartekari toxikoen pilaketa saihesteko, toxiko horien sorrera ekiditeaz gain, jadanik eraturiko oligomeroen desagregazioa gauzatzeko gai ere badelako. Sistema horren funtzionamendu efizienteak tolespen-arazoekin erlazionatutako gaixotasunak (hala nola parkinsona, alzheimerra edo alboko esklerosi amiotrofikoa) aurrezaintzeko gaitasuna dakar..
Minbizia eta apoptosia
Minbiziaren ezaugarri nagusietako bat minbizi-zelulen hilezkortasuna da. Izan ere, minbizi-zelulen zatiketa azkarra eta apoptosiarekiko erresistentzia dira tumorea handitzearen erantzule nagusiak15. Zelula kantzerigenoek bide desberdinak erabiltzen dituzte apoptosia ekiditeko, nagusiki seinale pro-apoptotikoen inhibizioa eta estimulu anti-apoptotikoen areagotzea. Horrela lortzen dute zelula tumoralak, estres handia jasan arren, apoptosian sartu gabe mantentzea. Hsp70 sistema estresaren aurkako mekanismoa izanda, minbizi-zeluletan oso ohikoa da Hsp70 txaperoiaren sobreespresioa, eta horrek apoptosiarekiko erresistentziari laguntzen dio16.
Hsp70 sistema minbiziarekiko itu terapeutiko gisa
Hsp70ak zelula tumoraletan duen garrantzia ikusita, badirudi itu terapeutiko egokia izan daitekeela minbizi-zelulek farmakoekiko duten erresistentzia murrizteko, eta beraz, tumoreak gutxitzeko 17. Zenbait ikerketaren arabera, Hsp70aren espresioa gutxitzea toxikoa da minbizi-zeluletan baina, aldiz, ez da nabarmena modifikatu gabeko zeluletan18. Hsp70aren inhibizioak eragin handiagoa du zelula tumoraletan, zelula horiek hiltzeko lehentasuna izango baitute zelula normalekin alderatuz gero. Izan ere, zelula tumoralaren fenotipoa (konstitutiboki estresatua) Hsp70aren funtzio babeslearen mende dago zitotoxizitateari aurre egiteko, eta, beraz, apoptosia ekiditeko19. Hrrnek asko zabaldu du Hsp70 sistemaren ikerketa-eremua; Hsp70 txaperoia itu gisa erabiltzeak etorkizun oparoa du, gaixotasun neurodegeneratiboen tratamendurako erabiltzeaz gain, minbiziaren tratamenduetarako ere baliagarria izan baitaiteke 19.
Erreferentziak
1- Crick F. 1970. “Central Dogma of Molecular Biology.” Nature, 227(5258): 561–63.
2- Bukau B., Weissman, J. eta Horwich, A. 2006. “Molecular Chaperones and Protein Quality Control.” Cell, 125(3): 443–51.
3- Gao X., Carroni M., Nussbaum-Krammer C, Mogk A., Nillegoda N.B., Szlachcic A., Guilbride D.L., Saibil H.R., Mayer M.P. eta Bukau B. 2015. “Human Hsp70 Disaggregase Reverses Parkinson’s-Linked α-Synuclein Amyloid Fibrils.” Molecular Cell, 59(5): 781–93.
4- Hartl F.U. 1996. “Molecular Chaperones in Cellular Protein Folding.” Nature, 381(6583): 571–79.
5- Morimoto R.I. 2008. “Proteotoxic stress and inducible chaperone networks in neurodegenerative disease and aging.” Genes & Developement, 22(11): 1427–1438.
6- Radwan M., Wood R.J., Sui X., eta Hatters D.M. 2017. “When proteostasis goes bad: protein aggregation in the cell.” IUBMB Life, 69, 49–54.7
7- Stroo E., Koopman M., Nollen E.A.A. eta Mata-Cabana A. 2017. “Cellular Regulation of Amyloid Formation in Aging and Disease.” Forntiers in Neuroscience, 11: 64.
8- Stetler R.A., Gan Y., Zhang W., Liou A.K., Gao Y., Cao G. eta Chen J. 2010. “Heat Shock Proteins: Cellular and Molecular Mechanisms in the Central Nervous System.” Progress in Neurobiology, 92(2): 184–211.
9- Goedert M. eta Spillantini M.G. 2006. “A century of Alzheimer’s disease.” Science, 314, 777–781.
10- Chaari A. 2019. “Molecular chaperones biochemistry and role in neurodegenerative diseases.” International Journal of Biological Macromolecules, 131:396-411.
11- Hartl F.U., eta Hayer-Hartl M. 2009. “Converging concepts of protein folding in vitro and in vivo.” Nature Structural and Molecular Biology, 16, 574–581.
12- Awasthi A., Matsunaga Y eta Yamada T. 2005. “Amyloid-beta causes apoptosis of neuronal cells via caspase cascade, which can be prevented by amyloid-beta-derived short peptides.” Experimental Neurology, 196(2): 282-289.
13- Okouchi M, Ekshyyan O., Maracine M. eta Aw T.Y. 2007. “Neuronal Apoptosis in Neurodegeneration.” Antioxidants & Redox Signaling, 9(8): 1059-1096.
14- Chi H., Chang H.Y eta Sang T.K. 2018. “Neuronal Cell Death Mechanisms in Major Neurodegenerative Diseases.” International Journal of Molecular Sciences, 19(10): 3082.
15- Hanahan D. eta Weinberg R.A. 2000. “The Hallmarks of Cancer.” Cell, 100(1): 57-70.
16- Brusa D., Migliore E., Garetto S., Simone M. eta Matera L. 2009. “Immunogenicity of 56 degrees C and UVC-treated prostate cancer is associated with release of HSP70 and HMGB1 from necrotic cells.” Prostate, 69: 1343–1352.
17- Gurbuxani S., Bruey J.M., Fromentin A., Larmonier N., Parcellier A., Jaattela M., Martin F., Solary E. eta Garrido C. 2001. “Selective depletion of inducible HSP70 enhances immunogenicity of rat colon cancer cells.” Oncogene, 20: 7478–7485.
18- Garrido C., Schmitt E., Cande C., Vahsen N., Parcellier A. eta Kroemer G. 2003. “HSP27 and HSP70: potentially oncogenic apoptosis inhibitors.” Cell Cycle, 2: 579–584.
19- Kumar S., Strokes J., Singh U.P., Gunn K.S., Acharya A., Manne U. eta Mishra M. 2016. “Targeting Hsp70: A possible therapy for cancer.” Cancer Letters, 374(1): 156-166.
Idatzi zuk zeuk Gai librean atalean
Gai librean aritzeko, bidali zure artikulua aldizkaria@elhuyar.eus helbidera
Hauek dira Gai librean atalean Idazteko arauak
Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia