A desorde e a morte da humanidade: son sinónimos?
Representar o estado. Catro acodes nunha habitación cadrada: dúas columnas e dúas filas, una á mesma distancia. Desde a perspectiva superior diriamos que esta ordenación é simétrica, é dicir, ordenada (figura 1).
Cambiemos o escenario. Pediuse a todas as persoas que se atopan dentro da sala que dean un paso que se limitou a catro direccións: cara adiante, cara atrás, cara á esquerda ou cara á dereita. Podería ser, sen acordo entre eles, que todos avanzasen. Se isto fose así, manterase a orde. A probabilidade de que cada una destas persoas tome esa decisión é reducida, dun cuarto porque cada una pode moverse en catro direccións. Pois a probabilidade de que catro persoas actúen por igual é aínda menor, 1 parte 4x4x4x4 ou 1 parte 256.
Si en lugar de avanzar cara adiante, cara atrás, cara á esquerda ou cara á dereita simultaneamente, a distribución non sufriría cambios, pero a probabilidade de manter a harmonía seguiría sendo de 4 a 256 ou de 1 a 64. Lixeiro ascenso, case despreciable [1].
Imos ao último escenario. Nesta ocasión déuselles a liberdade de ir a calquera dirección sen limitacións de mobilidade. Aquí si. Debido ás situacións posibles e interminables, será suficiente dar un paso paira romper definitivamente a ordenación simétrica e aumentar a desorde nun instante.
Todo iso, definindo una situación sinxela de catro acodes. Atopar millóns e millóns de átomos que poden moverse na natureza en infinitas direccións lévanos a concluír que os procesos que se producen de forma espontánea tenden a aumentar a desorde. Un claro exemplo diso é o afundimento dun barco, a explosión dun volcán, o fluxo de auga descendente dos arroios dos montes… O científico Rudolf Clausius chegou á mesma conclusión en 1850, e por primeira vez definiu o termo entropía e estableceu o segundo principio da termodinámica, co fin de dar una explicación aos procesos que ocorren na natureza [2].
Que é a entropía?
O primeiro principio da termodinámica é ben coñecido. Quizais non explicitamente, pero todos ouvimos falar do principio de conservación da enerxía equivalente. “A enerxía non se produce nin se destrúe, senón que se transforma” [3]. En grego, a palabra termodinámica significa movemento de calor, e o científico Rudolf viu que, en sistemas de distinta enerxía, este movemento sempre se producía coa tendencia a igualar a enerxía [4].
Vexamos máis claramente cun simple exemplo: un vaso cheo de xeo (Figura 2). Que pasará cos cubitos? Co tempo o xeo se derrite e desaparece. Por que? Polas diferentes concentracións de enerxía que podemos atopar no sistema. Inicialmente, as temperaturas ou enerxías do xeo e o medio son diferentes. Por tanto, este fluxo de enerxía transmítese de maior a menor concentración e estas enerxías tenderán a igualarse, é dicir, o medio achega calor ao xeo e a temperatura do xeo sobe e se derrite mentres o medio baixa.
Clausius definiu a entropía (S) paira indicar si ese movemento ou distribución de enerxía era uniforme ou non, e estableceu o segundo principio da termodinámica: canto máis uniforme dispérsese esta enerxía, maior entropía [4]. Dito doutro xeito, cando a enerxía distribúese de forma totalmente uniforme, a entropía do sistema é máxima [5]. Por tanto, a entropía dun corpo homoxéneo distribúese e expande automaticamente en todo o seu volume, pasando dun estado ordenado a un estado desordenado [6].
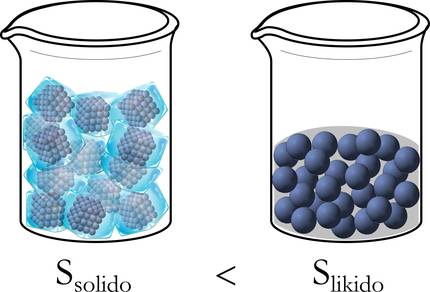
Paira comprender mellor, retomemos o exemplo de xeo antes mencionado. De feito, ao principio, en estado sólido, as moléculas están ben ordenadas: empaquetadas, sen liberdade de movemento. En cambio, ao pasar a estado líquido teñen unha marxe de desprazamento máis amplo e se desordenan, e máis aínda cando se transforma de líquido a gas (figura 3).
Revisemos agora a teoría de Rudolf no día a día. Por exemplo, é máis posible atopar a nosa habitación patas para arriba que atopar todo ordenado e correctamente. Podemos pensar que o mellor lugar paira gardar os nosos pantalóns é o armario, con cada un destes traxes colgados na súa propia percha. Con todo, pode ser cedida no chan, sobre a cadeira, na cama ou en calquera outro lugar. Parece que está escrito! Esta realidade é incontrolable e inevitable, xa que a probabilidade de manter a orde considérase despreciable. Por tanto, buscar a causa do aumento da entropía sería insignificante.
Como conseguir orde?
Aprendemos con experiencia que é moi difícil conseguir os nosos desexos sen esforzo. Á súa vez, o segundo principio da termodinámica sostén que os procesos non propios só poden producirse traballando no propio sistema.
Até agora, con todo, falamos unicamente de procesos propios (procesos espontáneos). Os feitos considerados non espontáneos son aqueles que non se producen de forma natural. E a que chamamos natural? Proceso de crecemento continuo da entropía. Estamos afeitos ver procesos que supoñen un aumento da entropía e, sen darnos conta, considerámolos normais.
Por tanto, todo proceso da nosa vida é sinal de que o tempo avanza. Se de súpeto observásemos que a entropía diminúe, a única maneira de explicalo sería pensar que o tempo vai cara atrás. Supoñamos que estamos a ver una película ao revés e vemos un prato caído da mesa ao chan, ao revés. Seguramente ririamos, porque sabemos que o feito de que ocorra desta maneira é imposible [1].
Por tanto, está claro que paira sucesos non espontáneos é necesario aplicar un traballo externo [6]. Con todo, a pesar da diminución da entropía, a entropía total do sistema e da súa contorna aumentará ao longo do tempo, debido a que a ordenación dun sistema implica sempre a desordenación doutros.
Imos cara á morte térmica?
Pódese dicir que a entropía do universo vai crecendo continuamente [7], dando así una visión pesimista paira o futuro. Un continuo aumento da desorde significa que as diferenzas de concentración de enerxía están a desaparecer. Ao igualar totalmente as enerxías dos sistemas, non se poderán conseguir ou realizar máis traballos nin se poderán producir máis cambios. En consecuencia, poderiamos dicir que nos estamos achegando á morte térmica?
Pensemos nun móbil. Os teléfonos móbiles funcionan grazas ás baterías, é dicir, á reacción química que se produce no seu interior. Xeran un fluxo de enerxía desde o punto de maior a menor concentración, o que provoca o funcionamento do móbil. Cando se esgota a reacción química dentro da batería ou se alcanza o estado de equilibrio, onde non poderemos ver cambios netos, o gradiente desaparece e obtense un nivel de enerxía uniforme. Noutras palabras, o móbil morre.
Paira resucitar o teléfono necesítase enerxía humana e provén fundamentalmente do sol. A nosa estrela está composta maioritariamente por hidróxeno, que, como todo o demais, está a degradarse. Dada a elevada densidade e temperatura, prodúcense reaccións termonucleares nas que os núcleos dos átomos de hidróxeno convértense en núcleos dos átomos de helio [4, 8]. De novo, un exemplo de igualación das concentracións de enerxía. Como sabemos hoxe en día, ao final do hidróxeno solar, a enerxía igualarase totalmente, e o mesmo ocorrerá con calquera outra estrela do universo, así como con todo o que hai no universo.
Se o segundo principio da termodinámica é aplicable a todo o universo, as concentracións de enerxía en todos os lugares están a igualarse e o cosmos está a degradarse. Cando esta enerxía está totalmente graduada, a entropía alcanzará o seu máximo e a partir de aí non ocorrerá nada. Aínda que a enerxía seguirá presente, non haberá tendencia ao cambio nin a xerar fluxos de enerxía paira iniciar reaccións.
Deberiamos perder a esperanza?
De feito, se nos fixamos na creación do universo, podemos ver un príncipe de luz. Nacemos da nada, e non será posible volver crealo de cero! Como indica a ecuación matemática, 0 = (+1) + (-1). É posible que de onde non hai nada póidase xerar enerxía positiva e negativa paira logo xerar algo maior a través dos cambios [1].
En calquera caso, non é tan grave. O proceso tardará varios anos en chegar ao final e o universo, tal e como existe, non só vivirá no noso tempo, senón en toda a vida da humanidade e da Terra [9].
Bibliografía:
[1] I. Asimov. 1977. Cen Preguntas Básicas sobre a Ciencia. Alianza Editorial, Madrid.
[2] R. Clausius. 1864. Abhandlungen über die mechanische Wärmetheorie. F. Vieweg, Harvard College Library.
[3] P. Atkins, J. Estafa. 2010 Atkins' Physical Chemistry. Oxford University Press, China.
[4] http://www1.euskadi.net/harluxet/
[5] R. Clausius. 1875. The mechanical theory of heat. Macmillan, Londres.
[6] R. J. Silbey, R. A. Alberty. 2001. Physical Chemistry. John Wiley & Sons, Inc.
[7] https://zthiztegia.elhuyar.eus/terminoa/eu/entropia.
[8] H. En Karttun, P. Kröger, H. Oja, M. Poutanen, and K. J. Donner. 2016 Fundamental astronomy. Springer, Finland.
[9] Ian Ridpath. 2016 Oxford Dictionary of Astronomy. Oxford University Press.