Le désordre et la mort de l'humanité : sont-ils synonymes ?
Représenter l'état. Quatre personnes dans une chambre carrée: deux colonnes et deux rangées, une à la même distance. Du point de vue supérieur, nous dirions que cette ordination est symétrique, c'est-à-dire ordonnée (figure 1).
Changeons le scénario. Il a été demandé à toutes les personnes qui se trouvent dans la salle de faire un pas qui a été limité à quatre directions: en avant, en arrière, à gauche ou à droite. Il pourrait être, sans accord entre eux, que tous avancent. Si c'était le cas, l'ordre sera maintenu. La probabilité que chacune de ces personnes prenne cette décision est réduite, d'une chambre parce que chacune peut se déplacer dans quatre directions. Car la probabilité que quatre personnes agissent de la même manière est encore inférieure, 1 partie 4x4x4 ou 1 partie 256.

Si au lieu d'avancer vers l'avant, vers l'arrière, vers la gauche ou vers la droite simultanément, la distribution ne subirait pas de changement, mais la probabilité de maintenir l'harmonie resterait de 4 à 256 ou de 1 à 64. Légère montée, presque négligeable [1].
Nous allons au dernier scénario. A cette occasion, ils ont été libres d'aller dans n'importe quelle direction sans limitations de mobilité. Ici oui. En raison des situations possibles et interminables, il sera suffisant de faire un pas pour briser définitivement l'ordination symétrique et augmenter le désordre en un instant.
Tout cela, définissant une situation simple de quatre personnes. Trouver des millions et des millions d'atomes qui peuvent se déplacer dans la nature dans des directions infinies nous amène à conclure que les processus qui se produisent spontanément ont tendance à augmenter le désordre. Un exemple clair en est l'effondrement d'un bateau, l'explosion d'un volcan, le flux d'eau descendant des ruisseaux des montagnes… Le scientifique Rudolf Clausius est arrivé à la même conclusion en 1850, et pour la première fois il a défini le terme entropie et a établi le deuxième principe de la thermodynamique, afin de donner une explication aux processus qui se produisent dans la nature [2].
Qu'est-ce que l'entropie?
Le premier principe de la thermodynamique est bien connu. Peut-être pas explicitement, mais nous avons tous entendu parler du principe de conservation de l'énergie équivalente. «L’énergie ne se produit pas et ne se détruit pas, mais se transforme» [3]. En grec, le mot thermodynamique signifie mouvement de chaleur, et le scientifique Rudolf a vu que, dans des systèmes d'énergie différente, ce mouvement se produisait toujours avec la tendance à égaler l'énergie [4].
Regardons plus clairement avec un simple exemple: un verre rempli de glace (figure 2). Que se passera-t-il avec les petits cubes ? Au fil du temps, la glace fond et disparaît. Pourquoi ? Pour les différentes concentrations d'énergie que nous pouvons trouver dans le système. Initialement, les températures ou les énergies de la glace et le milieu sont différents. Par conséquent, ce flux d'énergie est transmis de plus en plus faible concentration et ces énergies tendront à s'égaler, c'est-à-dire que le milieu apporte de la chaleur à la glace et la température de la glace monte et fond pendant que le milieu descend.
Clausius a défini l'entropie (S) pour indiquer si ce mouvement ou distribution d'énergie était uniforme ou non, et a établi le deuxième principe de la thermodynamique : plus cette énergie est uniformément dispersée, plus l'entropie [4]. En d'autres termes, lorsque l'énergie est distribuée uniformément, l'entropie du système est maximale [5]. L'entropie d'un corps homogène est donc automatiquement distribuée et étendue dans tout son volume, passant d'un état ordonné à un état désordonné [6].
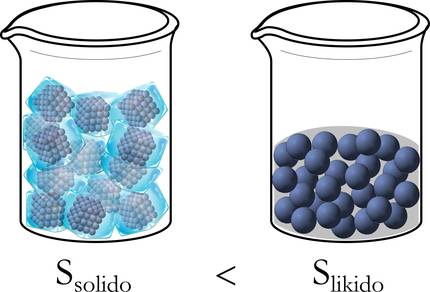
Pour mieux comprendre, reprenons l'exemple de glace mentionné ci-dessus. En fait, au début, à l'état solide, les molécules sont bien ordonnées: emballées, sans liberté de mouvement. En revanche, en passant à l'état liquide, ils ont une marge de déplacement plus large et se désordonnent, et plus encore lorsqu'ils sont transformés de liquide à gaz (Figure 3).
Examinons maintenant la théorie de Rudolf au jour le jour. Par exemple, il est plus possible de trouver notre chambre à l'étage que de trouver tout ordonné et correctement. Nous pouvons penser que le meilleur endroit pour garder nos pantalons est le placard, avec chacun de ces costumes accrochés sur votre propre cintre. Cependant, elle peut être cédée sur le sol, sur la chaise, dans le lit ou ailleurs. Il semble que c'est écrit ! Cette réalité est incontrôlable et inévitable, car la probabilité de maintenir l'ordre est considéré comme négligeable. Par conséquent, chercher la cause de l'augmentation de l'entropie serait négligeable.
Comment obtenir l'ordre ?
Nous avons appris avec expérience qu'il est très difficile d'obtenir nos désirs sans effort. À son tour, le deuxième principe de la thermodynamique soutient que les processus non propres ne peuvent se produire qu'en travaillant sur le système lui-même.
Jusqu'à présent, cependant, nous n'avons parlé que de processus propres (processus spontanés). Les faits considérés non spontanés sont ceux qui ne se produisent pas naturellement. Et ce que nous appelons naturel ? Processus de croissance continue de l'entropie. Nous sommes habitués à voir des processus qui supposent une augmentation de l'entropie et, sans nous en rendre compte, nous les considérons normaux.
Par conséquent, tout processus de notre vie est le signe que le temps avance. Si soudain nous observons que l'entropie diminue, la seule façon de l'expliquer serait de penser que le temps va en arrière. Supposons que nous voyons un film à l'envers et que nous voyons un plat tombé de la table au sol, à l'envers. Nous ririons sûrement, parce que nous savons que le fait qu'il arrive ainsi est impossible [1].
Il est donc clair que pour des événements non spontanés il faut appliquer un travail externe [6]. Cependant, malgré la diminution de l'entropie, l'entropie totale du système et de son environnement augmentera au fil du temps, parce que la gestion d'un système implique toujours le dérangement des autres.
Allons-nous vers la mort thermique ?
On peut dire que l'entropie de l'univers grandit continuellement [7], donnant ainsi une vision pessimiste pour l'avenir. Une augmentation continue du désordre signifie que les différences de concentration d'énergie disparaissent. En égalisant totalement les énergies des systèmes, il n'est pas possible d'obtenir ou d'effectuer d'autres travaux ni de produire d'autres changements. Par conséquent, pourrions-nous dire que nous approchons de la mort thermique?
Pensons à un mobile. Les téléphones mobiles fonctionnent grâce aux batteries, c'est-à-dire à la réaction chimique qui se produit à l'intérieur. Ils génèrent un flux d'énergie du point de plus à moins de concentration, ce qui provoque le fonctionnement du mobile. Lorsque la réaction chimique est épuisée dans la batterie ou que l'état d'équilibre est atteint, où nous ne pouvons pas voir des changements nets, le gradient disparaît et un niveau d'énergie uniforme est obtenu. En d'autres termes, le mobile meurt.
Pour ressusciter, le téléphone a besoin d'énergie humaine et provient essentiellement du soleil. Notre étoile est composée principalement d'hydrogène, qui, comme tout le reste, se dégrade. Compte tenu de la densité et de la température élevées, des réactions thermonucléaires se produisent dans lesquelles les noyaux des atomes d'hydrogène deviennent des noyaux des atomes d'hélium [4, 8]. Encore une fois, un exemple d'égalisation des concentrations d'énergie. Comme nous le savons aujourd'hui, à la fin de l'hydrogène solaire, l'énergie sera pleinement égalée, et il en sera de même pour toute autre étoile de l'univers, ainsi que pour tout ce qui est dans l'univers.
Si le deuxième principe de la thermodynamique est applicable à tout l'univers, les concentrations d'énergie dans tous les lieux sont égalées et le cosmos se dégradent. Lorsque cette énergie est totalement échelonnée, l'entropie atteindra son maximum et à partir de là, rien ne se produira. Bien que l'énergie restera présente, il n'y aura pas de tendance au changement ni à générer des flux d'énergie pour déclencher des réactions.
Devrions-nous perdre espoir ?
En fait, si nous regardons la création de l'univers, nous pouvons voir un prince de lumière. Nous sommes nés de nulle part, et il ne sera pas possible de le recréer de zéro ! Comme l'indique l'équation mathématique, 0 = (+1) + (-1). Il est possible que d'où il n'y a rien on puisse générer de l'énergie positive et négative pour ensuite générer quelque chose de plus par les changements [1].
En tout cas, ce n'est pas si grave. Le processus prendra plusieurs années pour arriver à la fin et à l'univers, tel qu'il existe, non seulement vivra dans notre temps, mais dans toute la vie de l'humanité et de la Terre [9].
Bibliographie:
[1] I. Asimov. 1977. Cent questions fondamentales sur la science. Alliance éditoriale, Madrid.
[2] R. Clausius. 1864. Abhandlungen über die mechanische Wärmetheorie. F. Vieweg, Harvard College Library.
[3] P. Atkins, J. Escroquerie. 2010 Atkins' Physical Chemistry. Oxford University Press, Chine.
[4] http://www1.euskadi.net/harluxet/
[5] R. Clausius. 1875. The mechanical theory of heat. Macmillan, Londres.
[6] R. J. Silbey, R. A. Alberty. 2001. Physical Chemistry. John Wiley Sons, Inc.
[7] https://zthiztegia.elhuyar.eus/terminoa/eu/entropia.
[8] H. À Karttun, P. Kröger, H. Oja, M. Poutanen, and K. J. Donner. 2016 Astronomy fondamentale. Springer, Finland.
[9] Ian Ridpath. 2016 Oxford Dictionary of Astronomy. Oxford University Press.