El desorden y la muerte de la humanidad: ¿son sinónimos?
Representar el estado. Cuatro personas en una habitación cuadrada: dos columnas y dos filas, una a la misma distancia. Desde la perspectiva superior diríamos que esta ordenación es simétrica, es decir, ordenada (figura 1).
Cambiemos el escenario. Se ha pedido a todas las personas que se encuentran dentro de la sala que den un paso que se ha limitado a cuatro direcciones: hacia delante, hacia atrás, hacia la izquierda o hacia la derecha. Podría ser, sin acuerdo entre ellos, que todos avanzaran. Si esto fuera así, se mantendrá el orden. La probabilidad de que cada una de estas personas tome esa decisión es reducida, de un cuarto porque cada una puede moverse en cuatro direcciones. Pues la probabilidad de que cuatro personas actúen por igual es aún menor, 1 parte 4x4x4x4 o 1 parte 256.

Si en lugar de avanzar hacia delante, hacia atrás, hacia la izquierda o hacia la derecha simultáneamente, la distribución no sufriría cambios, pero la probabilidad de mantener la armonía seguiría siendo de 4 a 256 o de 1 a 64. Ligero ascenso, casi despreciable [1].
Vamos al último escenario. En esta ocasión se les ha dado la libertad de ir a cualquier dirección sin limitaciones de movilidad. Aquí sí. Debido a las situaciones posibles e interminables, será suficiente dar un paso para romper definitivamente la ordenación simétrica y aumentar el desorden en un instante.
Todo ello, definiendo una situación sencilla de cuatro personas. Encontrar millones y millones de átomos que pueden moverse en la naturaleza en infinitas direcciones nos lleva a concluir que los procesos que se producen de forma espontánea tienden a aumentar el desorden. Un claro ejemplo de ello es el hundimiento de un barco, la explosión de un volcán, el flujo de agua descendente de los arroyos de los montes… El científico Rudolf Clausius llegó a la misma conclusión en 1850, y por primera vez definió el término entropía y estableció el segundo principio de la termodinámica, con el fin de dar una explicación a los procesos que ocurren en la naturaleza [2].
¿Qué es la entropía?
El primer principio de la termodinámica es bien conocido. Quizás no explícitamente, pero todos hemos oído hablar del principio de conservación de la energía equivalente. “La energía no se produce ni se destruye, sino que se transforma” [3]. En griego, la palabra termodinámica significa movimiento de calor, y el científico Rudolf vio que, en sistemas de distinta energía, este movimiento siempre se producía con la tendencia a igualar la energía [4].
Veamos más claramente con un simple ejemplo: un vaso lleno de hielo (Figura 2). ¿Qué pasará con los cubitos? Con el tiempo el hielo se derrite y desaparece. ¿Por qué? Por las diferentes concentraciones de energía que podemos encontrar en el sistema. Inicialmente, las temperaturas o energías del hielo y el medio son diferentes. Por lo tanto, este flujo de energía se transmite de mayor a menor concentración y estas energías tenderán a igualarse, es decir, el medio aporta calor al hielo y la temperatura del hielo sube y se derrite mientras el medio baja.
Clausius definió la entropía (S) para indicar si ese movimiento o distribución de energía era uniforme o no, y estableció el segundo principio de la termodinámica: cuanto más uniforme se disperse esta energía, mayor entropía [4]. Dicho de otro modo, cuando la energía se distribuye de forma totalmente uniforme, la entropía del sistema es máxima [5]. Por tanto, la entropía de un cuerpo homogéneo se distribuye y expande automáticamente en todo su volumen, pasando de un estado ordenado a un estado desordenado [6].
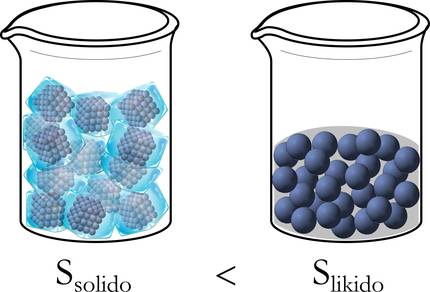
Para comprender mejor, retomemos el ejemplo de hielo antes mencionado. De hecho, al principio, en estado sólido, las moléculas están bien ordenadas: empaquetadas, sin libertad de movimiento. En cambio, al pasar a estado líquido tienen un margen de desplazamiento más amplio y se desordenan, y más aún cuando se transforma de líquido a gas (figura 3).
Revisemos ahora la teoría de Rudolf en el día a día. Por ejemplo, es más posible encontrar nuestra habitación patas arriba que encontrar todo ordenado y correctamente. Podemos pensar que el mejor lugar para guardar nuestros pantalones es el armario, con cada uno de estos trajes colgados en su propia percha. Sin embargo, puede ser cedida en el suelo, sobre la silla, en la cama o en cualquier otro lugar. ¡Parece que está escrito! Esta realidad es incontrolable e inevitable, ya que la probabilidad de mantener el orden se considera despreciable. Por lo tanto, buscar la causa del aumento de la entropía sería insignificante.
¿Cómo conseguir orden?
Hemos aprendido con experiencia que es muy difícil conseguir nuestros deseos sin esfuerzo. A su vez, el segundo principio de la termodinámica sostiene que los procesos no propios sólo pueden producirse trabajando en el propio sistema.
Hasta ahora, sin embargo, hemos hablado únicamente de procesos propios (procesos espontáneos). Los hechos considerados no espontáneos son aquellos que no se producen de forma natural. ¿Y a qué llamamos natural? Proceso de crecimiento continuo de la entropía. Estamos acostumbrados a ver procesos que suponen un aumento de la entropía y, sin darnos cuenta, los consideramos normales.
Por tanto, todo proceso de nuestra vida es señal de que el tiempo avanza. Si de repente observáramos que la entropía disminuye, la única manera de explicarlo sería pensar que el tiempo va hacia atrás. Supongamos que estamos viendo una película al revés y vemos un plato caído de la mesa al suelo, al revés. Seguramente nos reiríamos, porque sabemos que el hecho de que ocurra de esta manera es imposible [1].
Por lo tanto, está claro que para sucesos no espontáneos es necesario aplicar un trabajo externo [6]. Sin embargo, a pesar de la disminución de la entropía, la entropía total del sistema y de su entorno aumentará a lo largo del tiempo, debido a que la ordenación de un sistema implica siempre la desordenación de otros.
¿Vamos hacia la muerte térmica?
Se puede decir que la entropía del universo va creciendo continuamente [7], dando así una visión pesimista para el futuro. Un continuo aumento del desorden significa que las diferencias de concentración de energía están desapareciendo. Al igualar totalmente las energías de los sistemas, no se podrán conseguir o realizar más trabajos ni se podrán producir más cambios. En consecuencia, ¿podríamos decir que nos estamos acercando a la muerte térmica?
Pensemos en un móvil. Los teléfonos móviles funcionan gracias a las baterías, es decir, a la reacción química que se produce en su interior. Generan un flujo de energía desde el punto de mayor a menor concentración, lo que provoca el funcionamiento del móvil. Cuando se agota la reacción química dentro de la batería o se alcanza el estado de equilibrio, donde no podremos ver cambios netos, el gradiente desaparece y se obtiene un nivel de energía uniforme. En otras palabras, el móvil muere.
Para resucitar el teléfono se necesita energía humana y proviene fundamentalmente del sol. Nuestra estrella está compuesta mayoritariamente por hidrógeno, que, como todo lo demás, se está degradando. Dada la elevada densidad y temperatura, se producen reacciones termonucleares en las que los núcleos de los átomos de hidrógeno se convierten en núcleos de los átomos de helio [4, 8]. De nuevo, un ejemplo de igualación de las concentraciones de energía. Como sabemos hoy en día, al final del hidrógeno solar, la energía se igualará totalmente, y lo mismo ocurrirá con cualquier otra estrella del universo, así como con todo lo que hay en el universo.
Si el segundo principio de la termodinámica es aplicable a todo el universo, las concentraciones de energía en todos los lugares se están igualando y el cosmos se está degradando. Cuando esta energía está totalmente escalonada, la entropía alcanzará su máximo y a partir de ahí no ocurrirá nada. Aunque la energía seguirá presente, no habrá tendencia al cambio ni a generar flujos de energía para iniciar reacciones.
¿Deberíamos perder la esperanza?
De hecho, si nos fijamos en la creación del universo, podemos ver un príncipe de luz. Nacimos de la nada, ¡y no será posible volver a crearlo de cero! Como indica la ecuación matemática, 0 = (+1) + (-1). Es posible que de donde no hay nada se pueda generar energía positiva y negativa para luego generar algo mayor a través de los cambios [1].
En cualquier caso, no es tan grave. El proceso tardará varios años en llegar al final y el universo, tal y como existe, no sólo vivirá en nuestro tiempo, sino en toda la vida de la humanidad y de la Tierra [9].
Bibliografía:
[1] I. Asimov. 1977. Cien Preguntas Básicas sobre la Ciencia. Alianza Editorial, Madrid.
[2] R. Clausius. 1864. Abhandlungen über die mechanische Wärmetheorie. F. Vieweg, Harvard College Library.
[3] P. Atkins, J. Estafa. 2010 Atkins' Physical Chemistry. Oxford University Press, China.
[4] http://www1.euskadi.net/harluxet/
[5] R. Clausius. 1875. The mechanical theory of heat. Macmillan, Londres.
[6] R. J. Silbey, R. A. Alberty. 2001. Physical Chemistry. John Wiley & Sons, Inc.
[7] https://zthiztegia.elhuyar.eus/terminoa/eu/entropia.
[8] H. En Karttun, P. Kröger, H. Oja, M. Poutanen, and K. J. Donner. 2016 Fundamental astronomy. Springer, Finland.
[9] Ian Ridpath. 2016 Oxford Dictionary of Astronomy. Oxford University Press.