Desordena eta gizadiaren heriotza: sinonimoak ote?
Irudikatu egoera. Lau pertsona lauki-formako gela batean: bi zutabe eta bi lerro, bata bestearekiko distantzia berdinera. Goiko ikuspegitik, esango genuke antolamendu hori simetrikoa dela; ordenatua, alegia (1.irudia).
Alda dezagun agertokia. Gela barruan dagoen pertsona orori pauso bat emateko eskatu zaio, eta urrats hori lau norabidetara mugatu da: aurrerantz, atzerantz, ezkerrerantz ala eskuinerantz. Izan liteke, euren artean adostu gabe, denek aurreraka egitea. Hori horrela balitz, ordena mantenduko litzateke. Pertsona horietako bakoitzak erabaki hori hartzeko probabilitatea, baina, urria da: laurden batekoa, lau norabidetan mugitu daitekeelako bakoitza. Bada, lau pertsonek berdin jokatzeko probabilitatea oraindik eta baxuagoa da, 1 zati 4x4x4x4-koa edo 1 zati 256-koa.
Aurrerantz egin beharrean atzerantz, ezkerrerantz edo eskuinerantz aldi berean eginez gero ere, distribuzioan ez litzateke aldaketarik sumatuko; hala ere, harmonia mantentzeko probabilitateak 4 zati 256 eskas bat edo 1 zati 64 izaten jarraituko luke. Igoera ñimiñoa, ia arbuiagarria [1].
Goazen azken agertokira. Oraingoan, mugitzeko mugarik gabe edozein norabidetara jotzeko askatasuna eman zaie. Hemen, bai. Sortutako egoera posibleak amaigabeak direla medio, urrats bat ematea nahikoa izango da antolamendu simetrikoa behin betikoz hausteko eta istant batean desordena handitzeko.
Hori guztiori, lau pertsonaren egoera sinple bat definiturik. Naturan, infinitu norabidetan mugi daitezkeen milioika eta milioika atomo aurkitzeak honako hau ondorioztatzera garamatza: berez gertatzen diren prozesuek desordena handitzeko joera dutela. Horren adibide argia dira itsasontzi baten hondoratzea, sumendi baten leherketa, mendietako erreken goitik beherako ur-jarioa… Rudolf Clausius zientzialaria ondorio berberera heldu zen 1850ean, eta, lehenekoz, entropia hitza definitu, eta termodinamikaren bigarren printzipioa ezarri zuen, naturan berez gertatzen diren prozesuei azalpen bat ematea xede [2].
Zer da entropia?
Aski ezaguna da termodinamikaren lehen printzipioa. Beharbada ez esplizituki, baina denok entzun dugu inoiz haren baliokidea den energiaren kontserbazioaren printzipioa. “Energia ez da sortzen ez deuseztatzen, eraldatu baizik” [3]. Grezieraz, termodinamika hitzak bero-mugimendua esan nahi du, eta Rudolf zientzialariak ikusi zuen ezen, energia desberdineko sistemetan, mugimendu hori beti energia berdintzeko joerarekin gertatzen zela [4].
Ikus dezagun argiago adibide sinple batekin: izotzez betetako edalontzi bat (2. irudia). Zer gertatuko da izotz-puskekin? Denboraren poderioz, izotza urtu eta desagertu egingo da. Zer dela eta? Sisteman aurki ditzakegun energia-kontzentrazio desberdinengatik. Hasieran, izotzaren eta ingurunearen tenperaturak edo energiak desberdinak dira. Beraz, energia-fluxu hori kontzentrazio handienetik txikienera transmititzen da, eta energia horiek berdintzera joko dute; hots, inguruneak beroa ematen dio izotzari, eta izotzaren tenperatura igo eta urtu egiten da, ingurunekoa jaisten den bitartean.
Clausiusek, energia-mugimendu edo -banaketa hori uniformea zen ala ez adierazteko, entropia (S) definitu eta termodinamikaren bigarren printzipioa ezarri zuen: energia hori zenbat eta uniformeago barreiatu, orduan eta entropia handiagoa [4]. Beste era batera esanda, energia modu guztiz uniformean banatzen denean, sistemaren entropia maximoa da [5]. Hortaz, gorputz homogeneo baten entropia automatikoki banatzen eta zabaltzen da bolumen osoan; hau da, ordenatutako egoera batetik desordenatuta dagoen egoera batera igarotzen da [6].
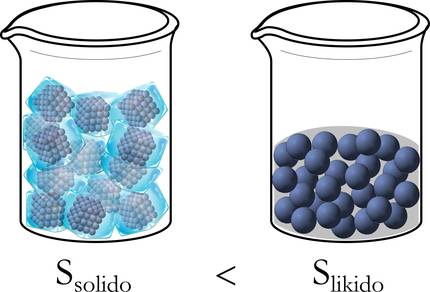
Hobeto ulertzeko, erreparatu diezaiogun berriz aurretik aipatutako izotzaren adibideari. Izatez, hasieran, egoera solidoan, molekulak ondo ordenatuta daude: paketatuta, mugitzeko askatasunik gabe. Likido egoerara pasatzean, ordea, mugitzeko tarte zabalagoa dute, eta desordenatu egiten dira; eta are gehiago likidotik gas egoerara eraldatzean (3.irudia).
Ikuska dezagun, orain, Rudolfen teoria egunerokotasunean. Esaterako, posibleago da gure gela hankaz gora aurkitzea, dena txukun eta behar bezala aurkitzea baino. Pentsa dezakegu gure galtzak gordetzeko leku aproposena armairua dela, jantzi horietako bakoitza dagokion pertxan txukun-txukun zintzilikatuta. Litekeena da, ordea, lurrean lagatzea, aulki gainean, ohean edota beste edozein tokitan. Idatzita dago, antza! Errealitate hori kontrolaezina eta saihetsezina da, zinez, ordena mantentzeko probabilitatea arbuiagarritzat jotzen baita. Horrenbestez, entropia handitzearen zergatia bilatzea hutsala litzateke.
Nola lortu ordena?
Eskarmentuz ikasi dugu oso zaila dela ahaleginik egin gabe gure nahiak lortzea. Halaber, termodinamikaren bigarren printzipioak gauza bera dio: berezkoak ez diren prozesuak sisteman bertan lana eginez bakarrik gerta daitezke.
Orain arte, baina, berezko prozesuez (prozesu espontaneoez) soilik hitz egin dugu. Ez-espontaneotzat hartzen diren gertakariak naturalki gertatzen ez direnak dira. Eta zeri deritzogu naturala? Entropiaren etengabeko handitze-prozesuari. Ohituta gaude oso entropia-igoera dakarten prozesuak ikustera, eta, konturatu gabe, normaltzat jotzen ditugu.
Horrenbestez, gure bizitzako prozesu oro denborak aurrera egiten duen seinale da. Bat-batean entropia gutxitzen dela ikusiko bagenu, hori azaltzeko modu bakarra denbora atzeraka doala pentsatzea izango litzateke. Demagun, film bat atzekoz aurrera ikusten ari garela eta mahaitik lurrera eroritako plater bat ikusten dugula, alderantziz. Seguru asko, barre egingo genuke, badakigulako gertaerak era horretan jazotzea ezinezkoa dela [1].
Hortaz, argi dago espontaneoak ez diren gertaerak jazotzeko ezinbestekoa dela kanpoko lan bat aplikatzea [6]. Hala ere, entropia jaitsi arren, luzarora sistemaren eta haren ingurunearen entropia totala handitu egingo da, unibertsoaren entropia hain zuzen; sistema bat ordenatzeak beste batzuk desordenatzea dakarrelako beti.
Heriotza termikorantz al goaz?
Esan daiteke unibertsoaren entropia etengabe handituz doala [7]; hala, ikuspuntu ezkorra ematen digu etorkizunerako. Desordena etengabe handitzeak esan nahi du energia-kontzentrazioaren aldeak desagertzen ari direla. Sistemen energiak erabat berdintzean, ezin izango da lan gehiago lortu edo egin, eta aldaketa gehiago gertatzea ez da posible izango. Ondorioz, esan al genezake heriotza termikorantz hurbiltzen ari garela?
Pentsa dezagun mugikor batean. Sakelako telefonoek bateriei esker funtzionatzen dute; alegia, haien barruan gertatzen den erreakzio kimikoari esker. Energia-fluxu bat sortzen dute kontzentrazio handieneko puntutik txikienekora, eta horrek eragiten du, hain justu ere, mugikorrak funtzionatzea. Bateria barruko erreakzio kimikoa agortzean edo oreka egoerara heltzean, non ezingo baitugu ikusi aldaketa netorik, gradientea desagertu egiten da, eta energia-maila uniformea lortzen da. Beste hitz batzuetan, mugikorra hil egiten da.
Telefonoa berpizteko, gizakion energia behar da, eta funtsean eguzkitik dator. Gure izarra gehienbat hidrogenoz osatuta dago, eta hura ere, beste gauza guztiak bezala, degradatzen ari da. Dentsitate eta tenperatura oso handiak direla eta, erreakzio termonuklearrak gertatzen dira: hidrogeno-atomoen nukleoak helio-atomoen nukleo bilakatzen dira [4, 8]. Berriz ere, energia-kontzentrazioen berdinketaren adibide bat. Gaur egun dakigunez, eguzkiko hidrogenoa bukatzean, energia guztiz berdinduko da, eta gauza bera gertatuko da unibertsoko beste edozein izarrekin; orobat unibertsoan dagoen guztiarekin.
Termodinamikaren bigarren printzipioa unibertso osoan aplikagarria bada, leku guztietako energia-kontzentrazioak berdintzen ari dira, eta kosmosa degradatzen ari da. Energia hori guztiz mailakatuta dagoenean, entropiak bere maximoa lortuko du, eta hortik aurrera ez da deus ere gertatuko. Energiak bertan jarraituko duen arren, ez da aldaketarako joerarik egongo, eta ez da energia-fluxurik sortuko erreakzioei hasiera emateko.
Esperantza guztiz galdu beharko genuke?
Izatez, unibertsoaren sorrerari erreparatuta, ikus dezakegu argi-printzarik. Ezerezetik sortu ginen, eta hutsetik berriro ere sortzeko modurik egongo ez da ba! Matematikako ekuazioak dioen bezala, 0 = (+1) + (-1). Akaso, ezer ez dagoen nonbaitetik energia positiboa eta negatiboa sor daiteke, ondoren, aldaketen bidez zeozer handiagoa sortzeko [1].
Nolanahi ere, ez da hainbeste larritzekoa. Prozesuak bilioika urte beharko ditu amaierara iristeko, eta unibertsoa, existitzen den bezala, ez da soilik gure garaian biziko, baizik eta gizadiaren eta Lurraren bizitza osoan [9].
Bibliografia:
[1] I. Asimov. 1977. Cien Preguntas Básicas Sobre la Ciencia. Alianza Editorial, Madrid.
[2] R. Clausius. 1864. Abhandlungen über die mechanische Wärmetheorie. F. Vieweg, Harvard College Library.
[3] P. Atkins, J. Paula. 2010. Atkins' Physical Chemistry. Oxford University Press, China.
[4] http://www1.euskadi.net/harluxet/
[5] R. Clausius. 1875. The mechanical theory of heat. Macmillan, London.
[6] R. J. Silbey, R. A. Alberty. 2001. Physical Chemistry. John Wiley & Sons, Inc.
[7] https://zthiztegia.elhuyar.eus/terminoa/eu/entropia.
[8] H. Karttunen, P. Kröger, H. Oja, M. Poutanen, and K. J. Donner. 2016. Fundamental astronomy. Springer, Finland.
[9] Ian Ridpath. 2016. Oxford Dictionary of Astronomy. Oxford University Press.
Idatzi zuk zeuk Gai librean atalean
Gai librean aritzeko, bidali zure artikulua aldizkaria@elhuyar.eus helbidera
Hauek dira Gai librean atalean Idazteko arauak
Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia










