Grandes Misterios de las Células Pequeñas Y cómo los Indicadores Fluorescentes se han convertido en información
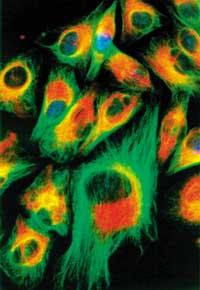
Los descubrimientos de última generación han dado la vuelta y media al mundo. Por un lado, las investigaciones orientadas al espacio nos han llevado al exterior de la tierra y a otros planetas. La idea de que en el Universo han existido o existen otras formas de vida es hoy más fuerte que nunca. Por otro lado, ha profundizado en los trabajos sobre la estructura de las partículas internas del átomo de viaje al interior, que también han aportado nuevas intenciones sobre el universo. Sin embargo, todavía son más las preguntas pendientes que las respuestas.
La célula viva es sin duda la estructura más compleja y sorprendente de nuestro planeta. Por un lado, por su rica información interna y su estructura compacta (pensemos, por ejemplo, que el programa de desarrollo para la creación de una ballena se almacena en pocos nanogramos de ADN). Por otro lado, cada célula desempeña un trabajo complejo en un lugar muy pequeño. En todo momento, miles de moléculas diferentes están llevando a cabo numerosas reacciones bioquímicas dentro de un plan metabólico concreto y catramílico. Al mismo tiempo, mantienen la estructura celular y, además, cumplen correctamente su función en un universo de células de todo el organismo (el número de células de nuestra sangre es superior al de la población mundial). Ante esta demostración, podemos pensar que la máquina más espectacular fabricada por el hombre es también un juguete torpe.
La mayoría de los fenómenos que se producen dentro de la célula son por el momento misterios. Sin embargo, se han conseguido algunos avances y el camino hacia la investigación está abierto.
Hasta hace pocos años, las reacciones se analizaban de forma individual o colectiva en los tubos de cristal tras la disolución de las células. Esta estrategia ha supuesto grandes avances. Entre otras cosas, se ha conseguido conocer la estructura y origen, origen y destino de muchos compuestos celulares. Ello ha permitido clarificar los principales procesos metabólicos como la glicolisis, el ciclo de Krebs, etc. Sin embargo, esta investigación, realizada fuera de la arquitectura celular, ha puesto en oscurecimiento otros muchos detalles como la velocidad real, la ubicación y la dirección espacial de los procesos que se producen en el interior de la célula. Por ejemplo, las relaciones entre las neuronas en el interior del cerebro no se han obtenido datos precisos, ya que en un espacio muy reducido se producen muchas y complejas reacciones.
Con el fin de superar los obstáculos mencionados anteriormente, los científicos han tratado de desarrollar nuevas técnicas que permitan analizar estos procesos de la vida manteniendo la integridad celular. Estas nuevas técnicas se basan en la espectroscopia. Es decir, una vez que una célula completa se ha irradiado por ondas electromagnéticas, las ondas recibidas atravesando la célula o por reflexión almacenan información sobre la estructura celular. En eso consiste la técnica utilizada en las radiografías. Los rayos X que obstruyen los huesos no llegan a la película, lo que nos permite obtener información sobre la forma del hueso.
La arquitectura molecular dentro de la célula es muy compleja, pero está compuesta por pocos tipos de moléculas. Por ejemplo, todas las proteínas de una bacteria (unas 3.000) están compuestas por una combinación de unos 20 aminoácidos diferentes. Descubre la fascinante habilidad de la vida. Lo mismo ocurre entre lípidos e hidratos de carbono. ¡El misterio está en la combinación!
Por lo tanto, y desgraciadamente ante las ondas electromagnéticas, todas las proteínas son similares, por lo que no es posible analizar el trabajo individual de cada una de ellas. No es éste el único problema: por un lado, la intensidad de la radiación utilizada y la longitud de onda (energía) deben estar dentro de límites que no afectan a la célula. Por otra parte, las células están formadas en gran medida por agua y muchos tipos de ondas no pueden utilizarse porque interfieren con el agua.
Si la investigación celular ha tenido que hacer frente a muchos problemas, algo parecido ha ocurrido cuando se ha tratado de investigar el espacio exterior, en muchos casos se han utilizado sondas. En otras palabras, se han realizado las máquinas adecuadas y posteriormente se han enviado al espacio para medir el parámetro que se pretende investigar. La señal de medida la recibimos por radio en la Tierra.
En los trabajos internos de las células, incluso ante los problemas mencionados anteriormente, se han creado moléculas indicadoras (o sondas). La sonda molecular debe ser capaz de realizar el mismo trabajo que la sonda espacial dentro de la célula. Básicamente las características principales de este tipo de sondas son:
- La señal espectroscópica (respuesta a las ondas) de todas las moléculas presentes en el interior de la célula es totalmente distinta y totalmente separada.
- Debe ser un indicador concreto de una reacción o molécula para que el investigador pueda investigar los fenómenos individualmente.
- El viaje al interior de la célula debe realizarse sin provocar fatiga celular. Además, la sonda debe tener una ubicación específica dentro de la célula y conocida: núcleo, citoplasma, mitocondria, etc.
- La estructura interna y la función de la célula deben ser normales en el momento de la medición. Evidentemente, la sonda que aglutina todas estas
características no es fácil de crear; todas las características de las máquinas que enviamos al espacio deben ser incorporadas dentro de una molécula. Afortunadamente, la colaboración entre químicos orgánicos y bioquímicos también nos ha dado resultados espectaculares en este campo. La fluorescencia ha sido su herramienta más útil.
¿Qué es la fluorescencia?
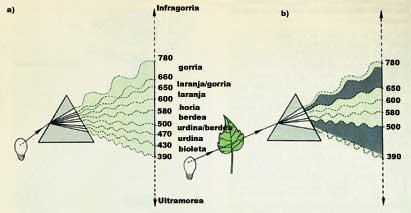
Es un fenómeno curioso que explican algunas moléculas y que ha resultado muy útil. Como la luz está formada por ondas, todas las moléculas absorben la luz de una determinada longitud de onda, atraviesan el resto de ondas o se reflejan a la vuelta. Como sabemos, la clorofila es verde; si tomamos como ejemplo, veremos que irradiando con luz blanca absorbe la luz azul (que tiene una longitud de onda entre 390 y 500 nm) y la roja (que tiene una longitud de onda entre 650 y 780 nm) y que los otros se ven reflejados a la vuelta. El color de la luz reflejada es la diferencia entre la luz radiada blanca y la absorbida: luz verde (entre 500 y 650 nm). Por lo tanto, todas las cosas que tienen color quitan algo a la luz blanca. Los blancos nada. Los negros todo. (Ver figura 1).
¿Qué ocurre con las ondas de luz absorbidas? Las ondas de la luz, como cualquier onda, transmiten energía y las moléculas que absorben las ondas pasan al estado excitado por la energía recibida. Para que vuelva a su estado energético normal, emite esta energía de otra manera. En muchos casos esta energía emitida es el calor formado por ondas de baja energía. En casos especiales, sin embargo, la energía de excitación absorbida se emite a través de otra onda visible y la energía de la luz emitida es siempre inferior a la luz absorbida. Dicho de otro modo, la molécula excitada expulsa la luz de otro color. Y esa es precisamente la fluorescencia.
Las luces negras de uso frecuente en las discotecas expulsan las ondas de alta energía que nosotros no podemos ver. Sin embargo, estas ondas tienen la capacidad de excitar varias moléculas. Estas moléculas excitadas emiten, a su vez, una luz azul-blanquecina. Por ejemplo, las camisas blancas, los dientes y la tónica aparecen como si tuvieran luz propia (por efecto de la fluorescencia).
Los compuestos fluorescentes naturales y artificiales son conocidos y pueden proporcionar información precisa sobre los procesos que se producen dentro de la célula cuando se utilizan como sonda.
Los indicadores fluorescentes se han utilizado para medir el pH interno de la célula. Los investigadores han colocado a SNARF y fluorescente, grupos que unen protones (H+), en una molécula fluorescente. A medida que la molécula se llena de protones, sus características de fluorescencia cambian y este fenómeno es medible.
Por otra parte, el llenado de protones depende de la concentración de los mismos. Por lo tanto, como se puede apreciar en la figura, un cambio en la concentración de los protones implica la modificación de las características de fluorescencia del indicador, que también puede medirse con gran precisión.
Mediante este sistema experto se han tenido que introducir este tipo de fluoróforos especiales para medir el pH interno de la célula sin provocar fatiga celular. Sin embargo, el sistema no puede ponerse a trabajar de cualquier manera. Quedan algunos problemas técnicos que habrá que superar y no de cualquier tipo. Los grupos que unen protones tienen carga eléctrica e interactúan con el agua (son por tanto hidrófilos).
Por otra parte, la célula tiene una membrana celular formada por proteínas y lípidos en el borde exterior, que controla bien el tráfico molecular entre el exterior y el interior. Este portero molecular no le permite introducirse en cualquier molécula cargada que no conoce y al tratarse de un indicador fluorescente artificial, no encuentra puerta de entrada. (Ver 2. imagen)
Ante este problema, los científicos han conseguido disfrazar a los grupos cargados mediante la esterificación. Con este cambio químico se consigue pasar de una molécula hidrófila a una hidrófoba, lo que le permite atravesar fácilmente la barrera lipídica que tiene delante sin pasar por la puerta especial. Una vez dentro, debido a la enzima esterasa que contiene las células, el éster hidrofóbico recupera la estructura original y el fluoroforo activo puede actuar como indicador dentro de la célula.

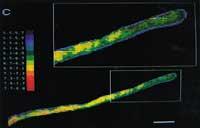
En algunos casos, el indicador fluorescente queda en el citosol, pero en otros se acumula en partes especiales de la estructura interna de la célula. Un solo cambio en el grupo químico puede tener gran influencia en el emplazamiento celular de la molécula. Por ejemplo, la fluoresceína queda en el citoplasma, pero la carboxifluoresq se acumula especialmente en el vaquero de las células vegetales. Estas diferencias se han utilizado para la realización de estudios especiales de fragmentos celulares (ver figura 3).
Las mediciones de pH de la célula han dado resultados muy importantes, pero el trabajo que más fama ha dado a los indicadores fluorescentes es, sin duda, la medición de la concentración de calcio(II) dentro de la célula. Las investigaciones llevadas a cabo en los últimos años han demostrado que este simple catión tiene una gran responsabilidad en el comportamiento interno de la célula, siendo su cometido el del segundo mensajero.
Normalmente, la concentración de calcio(II) de la célula (en el lenguaje de los científicos [Ca 2+ ]) es muy baja en el citoplasma (en torno a 10-7 M) debido a que la mayor parte de Ca 2+ de la célula se concentra en compartimentos especiales. Se acumula principalmente en animales en retículo endoplasmático y plantas en vacuolas.
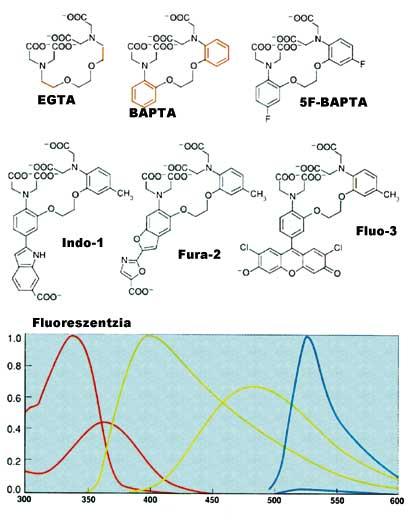
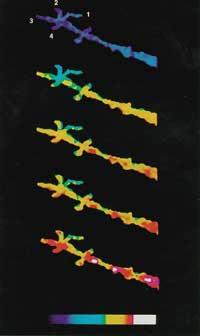
Tras recibir ciertas señales o estímulos externos, el calcio almacenado en los compartimentos es expulsado y el citoplasma asciende hasta 10 -5 M. Este aumento tiene una gran influencia en las proteínas especiales y genera cadenas de reacción. En el extremo final de estas cadenas de reacción se encuentra la expresión de los genes. Por tanto, es muy importante poder medir los cambios de calcio(II) dentro de la célula. El primer indicador fluorescente para medir Ca 2+ fue creado por Roger Tsien. EGTA, a partir del conocido complejo cálcico, crea la nueva estructura BAPTA. Gestión de residuos Este cambio modifica las características espectrales de BAPTA. Desgraciadamente, el espectro de absorción del BAPTA está próximo al resto de los compuestos que contiene la célula, lo que conlleva problemas de medición. Por ello, Tsien colocó otros grupos fluorescentes manteniendo el carácter molecular y las características del BAPTA, formando Quin-2, Fura-2, Indo-1 y finalmente Fluo-3 (ver figura 4).
Actualmente se puede medir a toda velocidad [Ca 2+ ] de la célula. Estas técnicas han demostrado que las respuestas químicas en las células son muy rápidas y precisas (ver figura 5).
La última revolución: ver las proteínas
Las proteínas son uno de los actores más representativos de las células. La información codificada en los genes se expresa en proteínas y éstas son las moléculas trabajadoras que realizan las diferencias. Por lo tanto, ver las diferentes proteínas trabajando dentro de la célula ha sido uno de los principales objetivos que los científicos han seguido sin cansarse. Gracias a la colaboración entre la ingeniería genética y la bioquímica se han publicado espectaculares resultados en los últimos años.

Dentro del código de información que tiene cada proteína se puede encontrar la señal de su dirección. Esta señal se encuentra en el extremo anterior de la proteína y le abre todas las puertas al lugar que va a ir. Al igual que la carta enviada por correo, la célula conduciría un complejo proceso de distribución de cada proteína. Finalmente, una vez alcanzada la proteína en su emplazamiento, la señal de dirección se elimina y en algunos casos se separa de otras áreas funcionales. En otras ocasiones sigue formando parte de la proteína.
Algunos animales marinos contienen proteínas que por sí mismas son fluorescentes. Debido a estas proteínas especiales, las medusas son conocidas desde hace tiempo y han sido utilizadas como indicadores fluorescentes para aclarar la dirección de otras proteínas.
Las bases de esta técnica espectacular son sencillas: se puede aislar previamente el gen de la proteína que se quiere investigar y colocar el gen del indicador fluorescente detrás o en el centro del gen; posteriormente se introduce una nueva copia en el interior de la célula para que continúe su camino. En ausencia de artefactos, el indicador fluorescente permite obtener una imagen exacta y espectacular de cuándo, dónde y cuánto hace la proteína investigada.
A la vista de las innovaciones existentes, se puede decir que con el uso de células vivas se publicarán muchos descubrimientos en el futuro; la belleza de los resultados obtenidos nos aportará mucho más que el placer del conocimiento.





