Agua: curiosidades de un líquido especial
Elhuyar Fundazioa
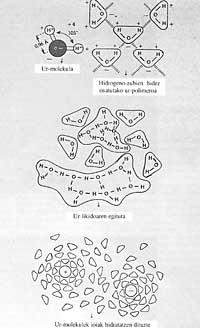
Molécula que no cumple la ley

El agua es una combinación de un átomo de oxígeno con dos de hidrógeno: H 2 O, sólo eso. Una fórmula muy sencilla y conocida, sin duda la primera que hemos aprendido. Al tratarse de una molécula tan simple, parece que si se quiere conocer algo al respecto bastaría con tomar cualquier libro de texto básico sobre química y sacar conclusiones de él. Su estructura no sugiere otras particularidades.
Lo primero que siempre se ha dicho del agua es que es un líquido en estado puro, sin color, ni olor, ni sabor. Pero a partir de ahí las propiedades son muy especiales y gracias a esa particularidad la vida en nuestro planeta.
Cuando Celsius inventó el termómetro, se basó en dos propiedades: la temperatura de ebullición del agua y la temperatura de congelación. El primero de ellos coincidió con 100°C y el segundo con 0°C. Dividió el espacio en cien partes iguales, cada una con un grado. Así nació el primer instrumento para medir la temperatura. Celsius no sabía, sin embargo, que estas dos propiedades no son normales en el agua en términos de magnitud. Los científicos saben que el punto de ebullición de un líquido tiene que ver con el tamaño de la molécula. Es decir, cuanto más pequeñas son las moléculas, menor es el punto de ebullición.
Esto supone que el agua, comparada con otras moléculas de su tamaño, tiene una temperatura de ebullición muy superior a la que correspondería.
Este punto puede ser analizado desde otro punto y la conclusión es similar. Se sabe que las propiedades de los compuestos derivados de elementos del mismo grupo de la Tabla Periódica no son de cualquier tipo, sino que pueden ser predecibles en función de su posición en la Tabla.
El oxígeno pertenece al mismo grupo que el azufre, el selenio, el teluro y el polonio y el agua, el hidruro de oxígeno, tiene la misma fórmula que los hidruros de los elementos de este grupo: H 2 S, H 2 Se, H 2 Te, H 2 Po. La temperatura de ebullición de todos estos compuestos es conocida y va aumentando regularmente desde el hidruro de la sufera hasta el polonio, que es más pesado.
Sin embargo, el agua no ha hecho caso a esta regularidad y tiene una temperatura de ebullición muy superior a la correspondiente. Gracias a ello, el agua es líquida a temperaturas normales y no gas, como el resto de los hidruros de esta familia.
Algo parecido ocurre con la temperatura de congelación, que es superior a la de los hidruros de otros elementos del grupo, que debería estar cerca de -100°C es de 0°C.
La tortuosidad del agua contra las leyes del sistema periódico hace que el estado líquido y sólido que presenta el agua en el suelo sea anormal, ya que de acuerdo con las leyes debería estar en estado gaseoso.

Otra no normalidad del agua es que el hielo es más ligero que el agua. Por eso los picos de iceberg quedan fuera del año. La experiencia física sobre este punto es todo lo contrario, ya que todas las demás sustancias son más pesadas en estado sólido (tienen mayor densidad) que en estado líquido.
Por ello, si se deposita un trozo sólido del metal en un metal fundido, nunca flotará, se hundirá.
Los cambios en la densidad del agua con la temperatura también son espectaculares. Todas las sustancias se dilatan con el calor y se contraen con el frío. Pero el agua no se conforma sólo con ella y tiene su máxima densidad a 4º C. Si se sigue enfriando por debajo de esta temperatura, en contra de lo que cabría esperar, su volumen aumenta hasta que se congela. Por eso las botellas se rompen cuando las dejamos olvidadas en el frigorífico.
La botella de vidrio tiene un comportamiento normal, por lo que se va contrayendo a medida que se va enfriando, pero el agua siempre debe hacer lo contrario y al congelarse aumenta su volumen. Y si no vamos rápido, la conclusión es conocida: la necesidad de poner trozos de vidrio en el frigorífico y una nueva botella refrescando.

Otra consecuencia ecológica y mucho más importante de esta máxima densidad es la congelación superficial a fondo de ríos, mares y lagos. Así, la capa superficial de hielo actúa como aislante y puede subsistir bajo las aguas heladas.
Cuando tras la lluvia se congela el agua que ha quedado en pequeñas franjas rocosas, debido a la enorme presión generada por este aumento del volumen del hielo, puede producirse una rotura de la roca o al menos la formación de grietas.
Otra característica importante del agua es su alto poder calorífico, que también tiene grandes consecuencias ecológicas, como el regulador del tiempo.
Cuando el invierno nos envía sus primeros fríos tiempos, el agua toma hielo y nieve, liberando la gran cantidad de calor que tenía almacenado. Así, los días fríos de invierno no los sentimos bruscos, ya que la temperatura ambiente se enfría más lentamente.
Y al revés, al fundir hielo y nieve, adquieren gran cantidad de calor del entorno y los días calurosos los sentimos más lentamente.
Por otro lado, la presencia de corrientes marinas calientes (como Gulf Stream) también tiene gran importancia en la regulación del tiempo. Esta corriente llega desde las tierras del tiempo tropical hasta las regiones frías del Ártico y del Antártico, donde el calor se va liberando. La cantidad de calor que fluye en este problema es realmente increíble. Veamos las cifras:

La cantidad de energía liberada por Gulf Stream al aire hora es igual a la generada por los ríos de 200 billones de toneladas de carbón. Esta cantidad de toneladas equivale aproximadamente a 2/3 de la producción anual de carbón. Dicho de otro modo, el alto poder calorífico del agua permite que los océanos absorban la energía solar y la conviertan en un enorme depósito de energía. Como hemos dicho, estas gigantescas masas de agua se desplazan lentamente hacia tierras frías liberando energía calurosa y templando el tiempo para evitar cambios drásticos.
Es cierto que nos hemos acostumbrado a mil cosas que ocurren a diario en la naturaleza y hemos perdido la capacidad de sorprendernos ante ellas y la curiosidad por encontrar su razón. ¿Puedes pensar alguna vez por qué hay lluvia formada por casi gotas redondas? Esto es debido a una extraña propiedad del agua.
A excepción de algunos metales líquidos, como el mercurio, y algunas sales fundidas, la tensión superficial del agua es superior a la de cualquier otra sustancia. La tensión superficial da la medida de la fuerza que provoca que el agua no se expanda sobre una superficie y quede en forma de gota, lo mismo ocurre en el aceite y en la gasolina.
Si la tensión superficial del agua fuera menor, incluso con el menor viento, las aguas marinas mojarían las tierras costeras. De la misma manera, nuestras precipitaciones y gabardinas harían poco si el agua tuviera poca tensión superficial, ya que pasaría por el tramo más pequeño. Sin embargo, los pocos productos denominados tensoactivos reducen fácilmente la tensión superficial del agua. Debido a esta propiedad que no tienen los otros líquidos, el agua (sudor) puede ascender por unos 80 m o más en tubos capilares muy estrechos de árboles, situados en lo alto para alimentar las hojas.
El uso de jabón lavamanos también tiene su razón, el jabón es tensoactivo y si no lo usáramos, debido a la alta tensión superficial del agua, el agua no llegaría a todas las ranuras, es decir, no nos mojaría bien las manos.
Agua en procesos de vida
A la luz de todas estas propiedades que hemos estudiado, podemos decir que el agua no es un líquido muy corriente. Y podemos asegurar además que es difícil encontrar una única propiedad del agua que pueda considerarse normal. Este peculiar comportamiento tiene gran importancia en muchos campos de la ciencia y la técnica, pero ahora vamos a pasar por alto el papel del agua en la subsistencia de la vida en nuestro planeta.
El agua participa en casi todas las reacciones bioquímicas. Veamos los caminos del cuerpo humano para obtener energía. Todos sabemos, entre otras cosas, que nos alimentamos de hidratos de carbono, que son la fuente de energía necesaria para todas las funciones del cuerpo. La reacción de los hidratos de carbono en la transformación de la energía es que la combustión de la glucosa, por el oxígeno, produce agua y dióxido de carbono.
La cantidad diaria de agua que necesita el cuerpo humano es de aproximadamente 2,5 l. Esta agua la obtenemos mediante la comida y la bebida, pero también mediante la reacción antes mencionada. La cantidad de agua generada por persona y día por esta última vía es de 0,3 l. De este modo, si no se renuevan los hidratos de carbono y el agua que consumimos las personas y los animales, se agotarían en breve. El equilibrio natural se consigue a través de las plantas, que reaccionan igual pero en sentido contrario con la energía solar. Es decir, las plantas sintetizan hidratos de carbono a partir del óxido de agua y carbono (IV). El reino vegetal de esta sencilla operación requiere 3 billones de litros de agua al día.
La reacción que se estudia requiere 185 l de oxígeno por persona y día. Como el oxígeno en el aire es sólo un 21% y la eficiencia de los pulmones humanos es del 14%, respiramos diariamente 6300 l de aire. Estas cifras no tienen relación con nuestro tema (el agua), pero nos ha parecido conveniente referirnos a nuestro entorno y sobre todo a nuestra dependencia del trabajo de las plantas.
Otro aspecto de la implicación del agua en los procesos de la vida viene ligado a su capacidad de disolvente. Es el medio de transporte de sustancias a través de organismos vivos. Para ello, el agua debe romper los enlaces entre los átomos o moléculas del cuerpo en estado sólido, separándolos del cuerpo de dichos átomos o moléculas para que queden dentro del agua. Debido a esta capacidad, el azúcar puede disfrutar de café con leche o sal de cocina para salar la comida.
Otra consecuencia de la capacidad disolvente del agua es que puede actuar como base bioquímica. Acabamos de ver la capacidad del agua como disolvente para desmontar la estructura de los cuerpos y ahora estamos diciendo algo que parece contradictorio; que tiene el papel de base bioquímica. Aunque parezca mentira, ahí no hay contradicciones, porque son aspectos de la misma función. En cuanto al primer aspecto, el agua mantiene en disolución sustancias simples como el azúcar o la sal, pero en el segundo, sustancias complejas como las enzimas ayudan a mantener la estructura.
Las enzimas son sustancias producidas por la naturaleza para poder conducir las reacciones bioquímicas necesarias para llevar a cabo las funciones del cuerpo. Las enzimas son proteínas, moléculas gigantes formadas por aminoácidos. Las enzimas, al igual que los collares de perla, pueden adoptar muchas formas (espaciales). En el caso de las enzimas, esta disposición espacial es de suma importancia, ya que para cumplir su función tiene que ser una disposición espacial muy precisa y diferente de todas las demás enzimas.
Los científicos todavía no conocen bien las fuerzas que hacen posible estas disposiciones, pero es seguro que para esta función el agua es necesaria. Si por cualquier motivo se modifica la composición de la solución acuosa que rodea a la enzima, ésta pierde su forma propia y, por tanto, su capacidad para desempeñar su función.
Todavía no está claro cómo el agua mantiene la estructura de la proteína actuando como base bioquímica. Lo que se puede decir es que las uniones agua-proteína son muy débiles y son muy fáciles de perurbar.
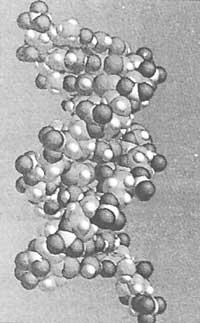
El papel de la base bioquímica no se limita al ámbito de las enzimas. Lo mismo ocurre con otras estructuras biológicas básicas como la doble hélice del ADN.
A la luz de los dos aspectos que hemos visto, el agua como disolvente y base bioquímica, se puede pensar que el papel del agua en la biología es estático. Pero, claro, esto no es así: el agua, como fluido biológico, transporta las sustancias necesarias para la vida (alimentos, oxígeno) a los lugares necesarios y a la vez expulsa los residuos generados por el metabolismo.
Para ver este comportamiento vamos a dar unas cifras. Cada latido cardiaco bombea 70 ml de sangre. Teniendo en cuenta que realiza 70 pulsaciones por minuto, hemos realizado operaciones sencillas y hemos conseguido que 7000 l de sangre circule por nuestro cuerpo. Otros órganos, como el riñón, también deben tratar grandes cantidades de agua.

Hemos visto que la presencia del agua en los seres vivos es importante, pero no todos los seres vivos tenemos la misma proporción de agua. Todas las formas de la vida y todos los tejidos de un determinado individuo tienen agua, pero en diferentes proporciones. El 60% del peso del cuerpo humano es agua y el 99,5% de la medusa. En nuestro cuerpo, el cerebro y los músculos son los que presentan una mayor proporción de agua y los huesos los que menos. Es conocido que cada célula necesita una cantidad mínima de agua para su funcionamiento, pero no se conoce mucho sobre las propiedades del agua en la célula.
Su estado, distribución, funciones y obligaciones y sus mecanismos de control de salida y entrada siguen siendo desconocidos. Por eso no sabemos la causa de problemas como el siguiente. El problema es que cuando los tejidos se congelan, el 20% de su agua nunca se congela, ni siquiera a temperaturas muy bajas. Parece que hay moléculas de agua que quedan protegidas y ocultas y que no pueden ocupar un lugar que les correspondería en el cristal de hielo. Este agua no sólo aparece en los seres vivos, sino que también ocurre algo parecido en los poros microscópicos de los minerales.
Y para terminar, vamos a ver cómo se adaptan algunos animales y plantas acuáticas para vivir en su interior.
La densidad del agua respecto al aire es tan alta que cualquier cuerpo en el agua es 800 veces más ligera que en el aire. Como consecuencia, las plantas y animales que habitan en el agua no necesitan de un esqueleto tan complejo como los que habitan en el suelo. Pero no todas son ventajas. La insolubilidad del oxígeno en el agua es limitada, por lo que las personas que viven en el medio acuático tienen dificultades respiratorias y han tenido que desarrollar complejos sistemas respiratorios.
Es evidente, por tanto, que vivir sumergido en el agua tiene sus problemas, pero no son menores los que viven en territorios con escasez de agua. Los seres vivos que se han adaptado a vivir en estos medios no tienen por ello una menor dependencia del agua. Por el contrario, el precio que han tenido que pagar ha sido muy caro, ya que han tenido que desarrollar mecanismos muy complejos para conservar el agua.

La mayor parte del agua que hay en nuestro planeta no es dulce, sino salada, con sólo el 0,3% del agua dulce disponible. La mayor parte de este agua se encuentra en los Polos y la otra fuente principal de agua dulce es el vapor de agua atmosférico. La cantidad de agua que se evapora anualmente se estima en 450.000 billones de litros. Para darnos cuenta de la magnitud de esta cantidad, pensad que si esa agua se expandiera uniformemente en nuestro planeta generaría una capa de agua de 106 cm de altura. El 75% de este vapor vuelve a los océanos en forma de lluvia y parte del resto lo hace también a través de los ríos.
La cantidad de agua en la atmósfera es de tan sólo 12000 billones de litros. Por lo tanto, encontraremos que haciendo una simple división, el agua de la atmósfera se recicla 37 veces al año.
No hay que decir, pero lo vamos a decir, que a medida que aumenta la población y el consumo de agua por habitante, y la proporción de las flechas de agua de este planeta, que es útil para nosotros, no sólo es un problema científico, sino también político y económico.






