Aigua: curiositats d'un líquid especial
Elhuyar Fundazioa
Molècula que no compleix la llei

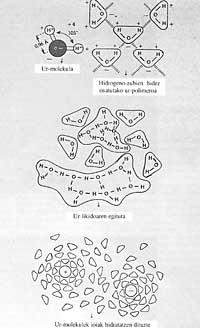
L'aigua és una combinació d'un àtom d'oxigen amb dos d'hidrogen: H 2 O, només això. Una fórmula molt senzilla i coneguda, sens dubte la primera que hem après. En tractar-se d'una molècula tan simple, sembla que si es vol conèixer alguna cosa sobre aquest tema bastaria amb prendre qualsevol llibre de text bàsic sobre química i treure conclusions d'ell. La seva estructura no suggereix altres particularitats.
El primer que sempre s'ha dit de l'aigua és que és un líquid en estat pur, sense color, ni olor, ni sabor. Però a partir d'aquí les propietats són molt especials i gràcies a aquesta particularitat la vida en el nostre planeta.
Quan Celsius va inventar el termòmetre, es va basar en dues propietats: la temperatura d'ebullició de l'aigua i la temperatura de congelació. El primer d'ells va coincidir amb 100 °C i el segon amb 0 °C. Va dividir l'espai en cent parts iguals, cadascuna amb un grau. Així va néixer el primer instrument per a mesurar la temperatura. Celsius no sabia, no obstant això, que aquestes dues propietats no són normals en l'aigua en termes de magnitud. Els científics saben que el punt d'ebullició d'un líquid té a veure amb la grandària de la molècula. És a dir, com més petites són les molècules, menor és el punt d'ebullició.
Això suposa que l'aigua, comparada amb altres molècules de la seva grandària, té una temperatura d'ebullició molt superior a la que correspondria.
Aquest punt pot ser analitzat des d'un altre punt i la conclusió és similar. Se sap que les propietats dels compostos derivats d'elements del mateix grup de la Taula periòdica no són de qualsevol tipus, sinó que poden ser predictibles en funció de la seva posició en la Taula.
L'oxigen pertany al mateix grup que el sofre, el seleni, el tel·luri i el poloni i l'aigua, l'hidrur d'oxigen, té la mateixa fórmula que els hidrurs dels elements d'aquest grup: H 2 S, H 2 Es, H 2 Et, H 2 Po. La temperatura d'ebullició de tots aquests compostos és coneguda i va augmentant regularment des de l'hidrur de la sufera fins al poloni, que és més pesat.
No obstant això, l'aigua no ha fet cas a aquesta regularitat i té una temperatura d'ebullició molt superior a la corresponent. Gràcies a això, l'aigua és líquida a temperatures normals i no gas, com la resta dels hidrurs d'aquesta família.
Alguna cosa semblança ocorre amb la temperatura de congelació, que és superior a la dels hidrurs d'altres elements del grup, que hauria d'estar prop de -100 °C és de 0 °C.
La tortuositat de l'aigua contra les lleis del sistema periòdic fa que l'estat líquid i sòlid que presenta l'aigua en el sòl sigui anormal, ja que d'acord amb les lleis hauria d'estar en estat gasós.

Una altra no normalitat de l'aigua és que el gel és més lleuger que l'aigua. Per això els pics d'iceberg queden fora de l'any. L'experiència física sobre aquest punt és tot el contrari, ja que totes les altres substàncies són més pesades en estat sòlid (tenen major densitat) que en estat líquid.
Per això, si es diposita un tros sòlid del metall en un metall fos, mai surarà, s'enfonsarà.
Els canvis en la densitat de l'aigua amb la temperatura també són espectaculars. Totes les substàncies es dilaten amb la calor i es contreuen amb el fred. Però l'aigua no es conforma només amb ella i té la seva màxima densitat a 4 °C. Si es continua refredant per sota d'aquesta temperatura, en contra del que caldria esperar, el seu volum augmenta fins que es congela. Per això les ampolles es trenquen quan les deixem oblidades en el frigorífic.
L'ampolla de vidre té un comportament normal, per la qual cosa es va contraient a mesura que es va refredant, però l'aigua sempre ha de fer el contrari i en congelar-se augmenta el seu volum. I si no anem ràpid, la conclusió és coneguda: la necessitat de posar trossos de vidre en el frigorífic i una nova ampolla refrescant.

Una altra conseqüència ecològica i molt més important d'aquesta màxima densitat és la congelació superficial a fons de rius, mars i llacs. Així, la capa superficial de gel actua com a aïllant i pot subsistir sota les aigües gelades.
Quan després de la pluja es congela l'aigua que ha quedat en petites franges rocoses, a causa de l'enorme pressió generada per aquest augment del volum del gel, pot produir-se un trencament de la roca o almenys la formació d'esquerdes.
Una altra característica important de l'aigua és el seu alt poder calorífic, que també té grans conseqüències ecològiques, com el regulador del temps.
Quan l'hivern ens envia els seus primers freds temps, l'aigua pren gel i neu, alliberant la gran quantitat de calor que tenia emmagatzemat. Així, els dies freds d'hivern no els sentim bruscos, ja que la temperatura ambient es refreda més lentament.
I a l'inrevés, en fondre gel i neu, adquireixen gran quantitat de calor de l'entorn i els dies calorosos els sentim més lentament.
D'altra banda, la presència de corrents marins calents (com Gulf Stream) també té gran importància en la regulació del temps. Aquest corrent arriba des de les terres del temps tropical fins a les regions fredes de l'Àrtic i de l'Antàrtic, on la calor es va alliberant. La quantitat de calor que flueix en aquest problema és realment increïble. Vegem les xifres:

La quantitat d'energia alliberada per Gulf Stream a l'aire hora és igual a la generada pels rius de 200 bilions de tones de carbó. Aquesta quantitat de tones equival aproximadament a 2/3 de la producció anual de carbó. Dit d'una altra manera, l'alt poder calorífic de l'aigua permet que els oceans absorbeixin l'energia solar i la converteixin en un enorme dipòsit d'energia. Com hem dit, aquestes gegantesques masses d'aigua es desplacen lentament cap a terres fredes alliberant energia calorosa i temperant el temps per a evitar canvis dràstics.
És cert que ens hem acostumat a mil coses que ocorren diàriament en la naturalesa i hem perdut la capacitat de sorprendre'ns davant elles i la curiositat per trobar la seva raó. Pots pensar alguna vegada per què hi ha pluja formada per gairebé gotes rodones? Això és degut a una estranya propietat de l'aigua.
A excepció d'alguns metalls líquids, com el mercuri, i algunes sals foses, la tensió superficial de l'aigua és superior a la de qualsevol altra substància. La tensió superficial dóna la mesura de la força que provoca que l'aigua no s'expandeixi sobre una superfície i quedi en forma de gota, el mateix ocorre en l'oli i en la gasolina.
Si la tensió superficial de l'aigua fos menor, fins i tot amb el menor vent, les aigües marines mullarien les terres costaneres. De la mateixa manera, les nostres precipitacions i gavardines farien poc si l'aigua tingués poca tensió superficial, ja que passaria pel tram més petit. No obstant això, els pocs productes denominats tensoactivos redueixen fàcilment la tensió superficial de l'aigua. A causa d'aquesta propietat que no tenen els altres líquids, l'aigua (suor) pot ascendir per uns 80 m o més en tubs capil·lars molt estrets d'arbres, situats al capdamunt per a alimentar les fulles.
L'ús de sabó rentamans també té la seva raó, el sabó és tensoactivo i si no l'uséssim, a causa de l'alta tensió superficial de l'aigua, l'aigua no arribaria a totes les ranures, és a dir, no ens mullaria bé les mans.
Aigua en processos de vida
A la llum de totes aquestes propietats que hem estudiat, podem dir que l'aigua no és un líquid molt corrent. I podem assegurar a més que és difícil trobar una única propietat de l'aigua que pugui considerar-se normal. Aquest peculiar comportament té gran importància en molts camps de la ciència i la tècnica, però ara passarem per alt el paper de l'aigua en la subsistència de la vida en el nostre planeta.
L'aigua participa en gairebé totes les reaccions bioquímiques. Vegem els camins del cos humà per a obtenir energia. Tots sabem, entre altres coses, que ens alimentem d'hidrats de carboni, que són la font d'energia necessària per a totes les funcions del cos. La reacció dels hidrats de carboni en la transformació de l'energia és que la combustió de la glucosa, per l'oxigen, produeix aigua i diòxid de carboni.
La quantitat diària d'aigua que necessita el cos humà és d'aproximadament 2,5 l. Aquesta aigua l'obtenim mitjançant el menjar i la beguda, però també mitjançant la reacció abans esmentada. La quantitat d'aigua generada per persona i dia per aquesta última via és de 0,3 l. D'aquesta manera, si no es renoven els hidrats de carboni i l'aigua que consumim les persones i els animals, s'esgotarien en breu. L'equilibri natural s'aconsegueix a través de les plantes, que reaccionen igual però en sentit contrari amb l'energia solar. És a dir, les plantes sintetitzen hidrats de carboni a partir de l'òxid d'aigua i carboni (IV). El regne vegetal d'aquesta senzilla operació requereix 3 bilions de litres d'aigua al dia.
La reacció que s'estudia requereix 185 l d'oxigen per persona i dia. Com l'oxigen en l'aire és només un 21% i l'eficiència dels pulmons humans és del 14%, respirem diàriament 6300 l d'aire. Aquestes xifres no tenen relació amb el nostre tema (l'aigua), però ens ha semblat convenient referir-nos al nostre entorn i sobretot a la nostra dependència del treball de les plantes.
Un altre aspecte de la implicació de l'aigua en els processos de la vida ve lligat a la seva capacitat de dissolvent. És el mitjà de transport de substàncies a través d'organismes vius. Per a això, l'aigua ha de trencar els enllaços entre els àtoms o molècules del cos en estat sòlid, separant-los del cos d'aquests àtoms o molècules perquè quedin dins de l'aigua. A causa d'aquesta capacitat, el sucre pot gaudir de cafè amb llet o sal de cuina per a salar el menjar.
Una altra conseqüència de la capacitat dissolvent de l'aigua és que pot actuar com a base bioquímica. Acabem de veure la capacitat de l'aigua com a dissolvent per a desmuntar l'estructura dels cossos i ara estem dient alguna cosa que sembla contradictori; que té el paper de base bioquímica. Encara que sembli mentida, aquí no hi ha contradiccions, perquè són aspectes de la mateixa funció. Quant al primer aspecte, l'aigua manté en dissolució substàncies simples com el sucre o la sal, però en el segon, substàncies complexes com els enzims ajuden a mantenir l'estructura.
Els enzims són substàncies produïdes per la naturalesa per a poder conduir les reaccions bioquímiques necessàries per a dur a terme les funcions del cos. Els enzims són proteïnes, molècules gegants formades per aminoàcids. Els enzims, igual que els collarets de perla, poden adoptar moltes formes (espacials). En el cas dels enzims, aquesta disposició espacial és de summa importància, ja que per a complir la seva funció ha de ser una disposició espacial molt precisa i diferent de tots els altres enzims.
Els científics encara no coneixen bé les forces que fan possible aquestes disposicions, però és segur que per a aquesta funció l'aigua és necessària. Si per qualsevol motiu es modifica la composició de la solució aquosa que envolta a l'enzim, aquesta perd la seva forma pròpia i, per tant, la seva capacitat per a exercir la seva funció.
Encara no és clar com l'aigua manté l'estructura de la proteïna actuant com a base bioquímica. El que es pot dir és que les unions aigua-proteïna són molt febles i són molt fàcils de perurbar.
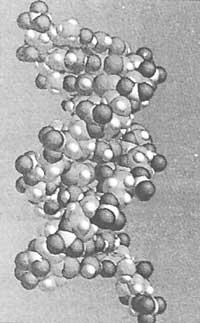
El paper de la base bioquímica no es limita a l'àmbit dels enzims. El mateix ocorre amb altres estructures biològiques bàsiques com la doble hèlix de l'ADN.
A la llum dels dos aspectes que hem vist, l'aigua com a dissolvent i base bioquímica, es pot pensar que el paper de l'aigua en la biologia és estàtic. Però, clar, això no és així: l'aigua, com a fluid biològic, transporta les substàncies necessàries per a la vida (aliments, oxigen) als llocs necessaris i alhora expulsa els residus generats pel metabolisme.
Per a veure aquest comportament donarem unes xifres. Cada batec cardíac bomba 70 ml de sang. Tenint en compte que realitza 70 pulsacions per minut, hem realitzat operacions senzilles i hem aconseguit que 7000 l de sang circuli pel nostre cos. Altres òrgans, com el ronyó, també han de tractar grans quantitats d'aigua.

Hem vist que la presència de l'aigua en els éssers vius és important, però no tots els éssers vius tenim la mateixa proporció d'aigua. Totes les formes de la vida i tots els teixits d'un determinat individu tenen aigua, però en diferents proporcions. El 60% del pes del cos humà és aigua i el 99,5% de la medusa. En el nostre cos, el cervell i els músculs són els que presenten una major proporció d'aigua i els ossos els que menys. És conegut que cada cèl·lula necessita una quantitat mínima d'aigua per al seu funcionament, però no es coneix molt sobre les propietats de l'aigua en la cèl·lula.
El seu estat, distribució, funcions i obligacions i els seus mecanismes de control de sortida i entrada continuen sent desconeguts. Per això no sabem la causa de problemes com el següent. El problema és que quan els teixits es congelen, el 20% de la seva aigua mai es congela, ni tan sols a temperatures molt baixes. Sembla que hi ha molècules d'aigua que queden protegides i ocultes i que no poden ocupar un lloc que els correspondria en el cristall de gel. Aquest aigua no sols apareix en els éssers vius, sinó que també ocorre alguna cosa semblança en els porus microscòpics dels minerals.
I per a acabar, veurem com s'adapten alguns animals i plantes aquàtiques per a viure en el seu interior.
La densitat de l'aigua respecte a l'aire és tan alta que qualsevol cos en l'aigua és 800 vegades més lleugera que en l'aire. Com a conseqüència, les plantes i animals que habiten en l'aigua no necessiten d'un esquelet tan complex com els que habiten en el sòl. Però no totes són avantatges. La insolubilitat de l'oxigen en l'aigua és limitada, per la qual cosa les persones que viuen en el mitjà aquàtic tenen dificultats respiratòries i han hagut de desenvolupar complexos sistemes respiratoris.
És evident, per tant, que viure submergit en l'aigua té els seus problemes, però no són menors els que viuen en territoris amb escassetat d'aigua. Els éssers vius que s'han adaptat a viure en aquests mitjans no tenen per això una menor dependència de l'aigua. Per contra, el preu que han hagut de pagar ha estat molt car, ja que han hagut de desenvolupar mecanismes molt complexos per a conservar l'aigua.

La major part de l'aigua que hi ha en el nostre planeta no és dolç, sinó salada, amb només el 0,3% de l'aigua dolça disponible. La major part d'aquest aigua es troba en els Pols i l'altra font principal d'aigua dolça és el vapor d'aigua atmosfèric. La quantitat d'aigua que s'evapora anualment s'estima en 450.000 bilions de litres. Per a adonar-nos de la magnitud d'aquesta quantitat, penseu que si aquesta aigua s'expandís uniformement en el nostre planeta generaria una capa d'aigua de 106 cm d'altura. El 75% d'aquest vapor torna als oceans en forma de pluja i part de la resta el fa també a través dels rius.
La quantitat d'aigua en l'atmosfera és de tan sols 12000 bilions de litres. Per tant, trobarem que fent una simple divisió, l'aigua de l'atmosfera es recicla 37 vegades a l'any.
No cal dir, però ho direm, que a mesura que augmenta la població i el consum d'aigua per habitant, i la proporció de les fletxes d'aigua d'aquest planeta, que és útil per a nosaltres, no sols és un problema científic, sinó també polític i econòmic.






