Angiogenèse tumorale
Farmazian doktorea. Biofarmazia, Farmakozinetika eta Farmazia-teknologiako irakasle kolaboratzailea
Farmazia Fakultatea UPV-EHU, Vitoria-Gasteiz
Au cours des 30 dernières années, de nombreux groupes de recherche de nombreux pays ont consacré leurs efforts à guérir cette maladie. Oui, même si c'est l'une des modifications les plus étudiées et étudiées d'un point de vue biologique et moléculaire, il ya encore beaucoup de doutes à résoudre et est sur le point de trouver le traitement de nombreux types de cancer. En fait, la diversité des types de cancer rend pratiquement impossible la découverte d’une «balle magique» ou, ce qui est le même, le développement d’un traitement contre tout type de cancer. Par conséquent, les objectifs scientifiques visent, d'une part, à la recherche de solutions spécifiques pour chaque type de cancer et, d'autre part, au développement de nouvelles stratégies thérapeutiques qui complètent ou remplacent les techniques actuelles de chirurgie, chimiothérapie et radiothérapie.
Une de ces nouvelles stratégies contre le cancer est la thérapie contre l'angiogenèse. Cette stratégie de plus en plus importante est basée sur l'inhibition de la création de nouveaux vaisseaux sanguins qui nourrissent et portent la tumeur (Folkman, 1971). Dans ce travail, outre l'importance de l'angiogenèse dans le développement du cancer, les possibilités thérapeutiques offertes par ses inhibitions seront analysées.
Qu'est-ce que l'angiogenèse tumorale?
Les facteurs qui interviennent dans la création et la diffusion du cancer sont nombreux. Ces facteurs, héréditaires et épigénétiques, modifient le matériel génétique des cellules, en particulier celui relatif à leur capacité de reproduction. Par conséquent, une cellule qui auparavant était divisée de façon contrôlée et limitée la rend infinie. Cependant, la croissance du cancer n'est pas uniquement due à l'immortalité cellulaire.
Dans le cancer de la prostate, par exemple, la fraction des cellules divisées est seulement de 2% (Berges, 1995), et 90-99% des cellules tumorales produites meurent par manque de nutriments. Que signifie cela ? Que de nombreux types de cancer ont besoin d'un nouvel événement pour maintenir la population cellulaire en développement. Ce phénomène est l'angiogenèse.
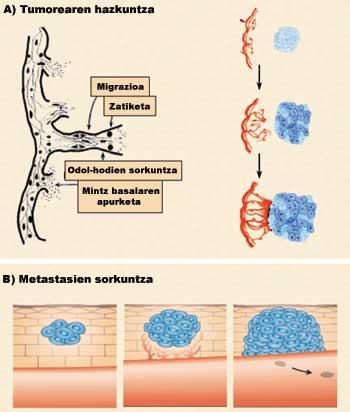
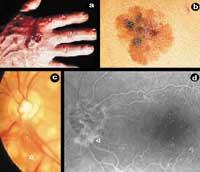
L'angiogenèse est donc le processus de formation de nouveaux vaisseaux sanguins à partir de ceux déjà existants. Les nouveaux vaisseaux sanguins, en plus de nourrir la tumeur, permettront sa métastase, c'est-à-dire son extension aux nouvelles parties du corps. Pour qu'un petit village devienne ville, comme les routes qui communiquent des maisons en dehors des nouvelles, le cancer a besoin, en plus des cellules, des vaisseaux sanguins pour se nourrir, grandir et se développer. Cependant, l'angiogenèse n'est pas seulement un phénomène lié au cancer, elle est aussi un processus qui se produit dans certaines situations physiologiques (cycle menstruel et cicatrisation) et physiopathologiques (psoriasis et rétinopathie diabétique) (Figure 1).
Début, phases et effets de l'angiogenèse tumorale
La formation de nouveaux vaisseaux sanguins reflète le besoin de nutriments et d'oxygène de la tumeur. Lorsque ce besoin apparaît, les cellules tumorales sécrètent des substances appelées «facteurs angiogéniques» ou «régulateurs positifs». Ces facteurs affectent les cellules endothéliales des vaisseaux sanguins et déclenchent l'angiogenèse.
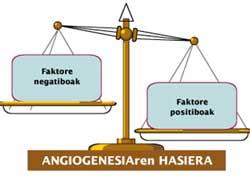
Dans des conditions normales, la concentration de ces facteurs est en équilibre avec la concentration des autres avec effet négatif. Ces dernières sont appelées ‘antiangiogéniques’ ou ‘régulateurs négatifs’. Le cancer, favorisant la concentration relative de régulateurs positifs qui excitent la formation de nouveaux vaisseaux sanguins (figure 2), brise cet équilibre.
L'angiogenèse est divisée en quatre phases (Figure 3). Dans une première phase, la membrane basale des vaisseaux sanguins existants est brisée (première phase : rupture de la membrane basale). En conséquence, les cellules endothéliales sont expulsées du vaisseau sanguin et dispersées dans la zone tumorale (2ème phase : migration). Sur ce chemin, les cellules se divisent (Phase 3: Division). Enfin, les cellules se lient entre elles à travers différentes protéines adhésives formant un nouveau vaisseau sanguin (Phase 4: liaison des cellules).
Le développement de ces quatre étapes a deux conséquences principales: d'une part, la croissance tumorale due aux nutriments, à l'oxygène et aux facteurs stimulants (Figure 3.a), et d'autre part, l'introduction de cellules tumorales dans les vaisseaux sanguins, qui par voie sanguine s'étendent à d'autres parties du corps et provoquent de nouvelles tumeurs (Figure 3.b).
Inhibition de l'angiogenèse tumorale
On connaît actuellement la relation entre la vitalité de l'angiogenèse tumorale, la fréquence de métastases et la réduction de l'espérance de vie des patients (Pluda, 1997). Par conséquent, l'inhibition effective de l'angiogenèse est devenue l'objectif de nombreux scientifiques. Surtout, éviter la formation de nouveaux vaisseaux sanguins, car en plus d'inhiber la métastase, il réduira la taille de la tumeur, facilitant l'éradication du cancer par chimiothérapie ou chirurgie.
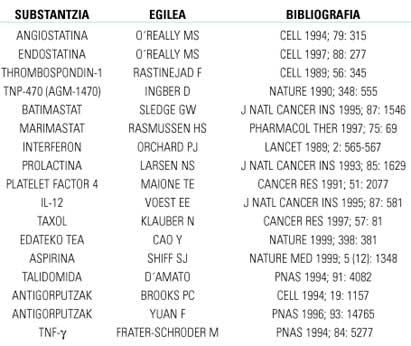
Compte tenu de ce qui précède exposé, une façon simple d'inhiber l'angiogenèse serait de la diriger vers les équilibres régulateurs négatifs des facteurs. Cela peut être réalisé de deux façons: en inhibant les facteurs positifs ou en encourageant les facteurs négatifs. On peut également inhiber n'importe quelle phase de l'angiogenèse si des enzymes et/ou des protéines impliquées sont bloquées. Le tableau 1 présente les médicaments les plus efficaces contre l'angiogenèse étudiés chez les animaux de laboratoire. Parmi eux, seuls ceux qui offrent les meilleurs résultats et plus de sécurité essayeront sur les humains avec des sessions cliniques.
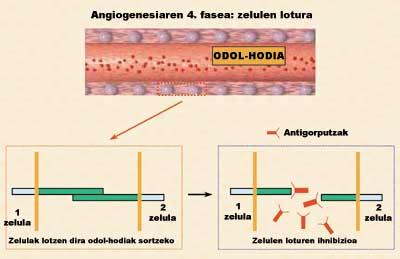
Parmi les quatre phases de l'angiogenèse, l'une des plus intéressantes est celle qui a le moins été étudiée d'un point de vue thérapeutique. C'est pourquoi le laboratoire de pharmacie et de technologie pharmaceutique de la Faculté de pharmacie (UPV/EHU) a lancé une nouvelle étude d'inhibition de l'angiogenèse pour bloquer cette quatrième phase. L'objectif de la recherche était d'inhiber certaines protéines adhésives qui permettent la liaison entre les cellules endothéliales. Des cellules sécrétant des anticorps spécifiques ont été utilisées pour inhiber ou bloquer ces protéines (figure 4). Cependant, si les cellules étaient gérées comme telles, elles élimineraient rapidement les systèmes immunologiques des animaux en les considérant inconnus.
Pour résoudre ce problème, nous les regroupons en sphères polymères de petite taille qui protège les cellules contre le système immunitaire. Ce processus est appelé microencapsulation cellulaire (Orive G, 2000). Dans ces petites capsules, les cellules, en plus de croître, sécrétaient l'anticorps qui nous intéressait. Cette nouvelle stratégie anti-angiogenèse a deux principaux avantages: d'une part, l'inhibition d'une protéine peu étudiée et de l'autre, la sécrétion continue et prolongée d'anticorps par les cellules.
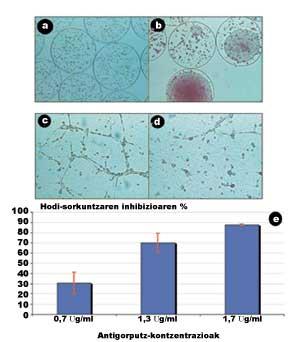
La figure 5 présente certains des résultats obtenus dans cette étude (Orive G, 2001). Dans les images suivantes, obtenues au microscope, on observe que les cellules se développent et se divisent rapidement à l'intérieur des capsules, entraînant la formation d'agrégats violents (Figures 5.a et 5.b).
Dans une autre session, nous analysons la capacité des anticorps sécrétés à bloquer la liaison entre les cellules endothéliales. Pour ce faire, les cellules endothéliales ont été stimulées par des facteurs de croissance. Ces facteurs ont étiré les cellules et facilité les unions entre elles, créant des vaisseaux sanguins immatures (tubules), c'est-à-dire des structures antérieures aux vaisseaux sanguins qui alimenteront la tumeur. Comme le montre la figure 5.c, en l'absence d'anticorps, les relations entre les cellules endothéliales sont très notables.
Au contraire, lorsque la dissolution d'anticorps avec une concentration de 1,7 µg/ml a été introduite, les unions intercellulaires et donc la formation de tubules ont été presque complètement inhibées (figure 5.d). Quelle est sa signification ? Que l'anticorps sécrétant les cellules encapsulées a la capacité d'inhiber l'angiogenèse et que le blocage des protéines adhésives est une bonne stratégie pour inhiber l'angiogenèse tumorale. En outre, une dernière session a montré que le rapport entre la traction concertistique anticorps et la capacité d'inhiber l'angiogenèse est directement proportionnelle (Figure 5.e).
Ces résultats initiaux encourageants nous ont conduit à une nouvelle recherche dans laquelle nous utiliserons la thérapie génique comme base pour inhiber l'angiogenèse tumorale.
Fin de la fin
Depuis les années 90, l'angiogenèse est devenue de plus en plus intéressante pour les scientifiques et l'industrie. En fait, plus de 25 médicaments contre l'angiogenèse sont traités dans des séances cliniques (Kerbel, 2000). L'intérêt actuel se concentre non seulement sur la découverte de nouveaux médicaments, mais aussi sur la combinaison de stratégies antiangiogenèse et de stratégies conventionnelles contre le cancer (chimiothérapie, radiothérapie et chirurgie).
Cette dernière idée a une grande importance étant donné que la combinaison de plusieurs stratégies peut prédire des effets synergiques, c'est-à-dire des effets plus bénéfiques que ceux obtenus individuellement par ces stratégies. En outre, de nouvelles stratégies d'administration (anticorps monoclonaux, thérapie génique, etc. ). ), permettent de nouvelles solutions pour inhiber l'angiogenèse et ainsi contrôler les cancers.
En définitive, même s'il reste encore beaucoup à faire, le travail quotidien et le sommeil le plus doux de tous les scientifiques est de faire siennes les mauvaises maladies.