Angiogénesis tumoral
Farmazian doktorea. Biofarmazia, Farmakozinetika eta Farmazia-teknologiako irakasle kolaboratzailea
Farmazia Fakultatea UPV-EHU, Vitoria-Gasteiz
En los últimos 30 años, muchos grupos de investigación de muchos países han dedicado sus esfuerzos a curar esta enfermedad. Eso sí, aunque es una de las alteraciones más estudiadas y estudiadas desde un punto de vista biológico y molecular, todavía hay muchas dudas que resolver y está a punto de encontrar el tratamiento de muchos tipos de cáncer. De hecho, la diversidad de tipos de cáncer hace que el descubrimiento de una ‘bala mágica’ o, lo que es lo mismo, el desarrollo de un tratamiento contra todo tipo de cáncer sea prácticamente imposible. Por ello, los objetivos científicos se dirigen, por un lado, a la búsqueda de soluciones específicas para cada tipo de cáncer y, por otro, al desarrollo de nuevas estrategias terapéuticas que complementen o sustituyan a las técnicas actuales de cirugía, quimioterapia y radioterapia.
Una de estas nuevas estrategias contra el cáncer es la terapia contra la angiogénesis. Esta estrategia de creciente importancia se basa en la inhibición de la creación de nuevos vasos sanguíneos que alimentan y visten el tumor (Folkman, 1971). En este trabajo, además de incidir en la importancia de la angiogénesis en el desarrollo del cáncer, se analizarán las posibilidades terapéuticas que ofrecen sus inhibiciones.
¿Qué es la angiogénesis tumoral?
Los factores que intervienen en la creación y difusión del cáncer son numerosos. Estos factores, tanto hereditarios como epigenéticos, modifican el material genético de las células, especialmente el relativo a su capacidad reproductiva. Por lo tanto, una célula que antes se dividía de forma controlada y limitada la hace infinita. Sin embargo, el crecimiento del cáncer no se debe únicamente a la inmortalidad celular.
En el cáncer de próstata, por ejemplo, la fracción de células que se dividen es sólo un 2% (Berges, 1995), y el 90-99% de las células tumorales generadas mueren por falta de nutrientes. ¿Qué significa esto? Que muchos tipos de cáncer necesitan de un nuevo suceso para mantener la población celular en desarrollo. Este fenómeno es la angiogénesis.
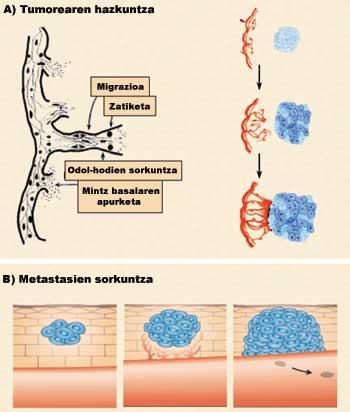
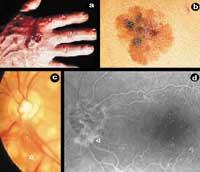
La angiogénesis, por tanto, es el proceso de formación de nuevos vasos sanguíneos a partir de los ya existentes. Los nuevos vasos sanguíneos, además de alimentar el tumor, permitirán su metástasis, es decir, su extensión a las nuevas partes del cuerpo. Para que un pequeño pueblo se convierta en ciudad, como las carreteras que comunican casas aparte de las nuevas, el cáncer necesita, además de células, vasos sanguíneos para alimentarse, crecer y expandirse. Sin embargo, la angiogénesis no es sólo un fenómeno relacionado con el cáncer, sino que también es un proceso que se produce en ciertas situaciones fisiológicas (ciclo menstrual y cicatrización) y fisiopatológicas (psoriasis y retinopatía diabética) (Figura 1).
Inicio, fases y efectos de la angiogénesis tumoral
La formación de nuevos vasos sanguíneos es un reflejo de la necesidad de nutrientes y oxígeno del tumor. Cuando aparece esta necesidad, las células tumorales segregan sustancias llamadas “factores angiogénicos” o “reguladores positivos”. Estos factores afectan a las células endoteliales de los vasos sanguíneos e inician la angiogénesis.
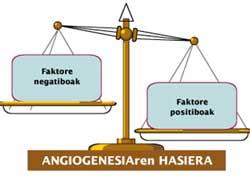
En condiciones normales, la concentración de estos factores está en equilibrio con la concentración de otros con efecto adverso. Estas últimas se denominan ‘antiangiogénicas’ o ‘reguladores negativos’. El cáncer, fomentando la concentración relativa de reguladores positivos que excitan la formación de nuevos vasos sanguíneos (Figura 2), rompe este equilibrio.
La angiogénesis se divide en cuatro fases (figura 3). En una primera fase se rompe la membrana basal de los vasos sanguíneos ya existentes (1ª fase: rotura de la membrana basal). Como consecuencia de ello, las células endoteliales son expulsadas del vaso sanguíneo y dispersas a la zona tumoral (2ª fase: migración). En este camino las células van dividiéndose (Fase 3: División). Finalmente, las células se unen entre sí a través de diferentes proteínas adhesivas formando un nuevo vaso sanguíneo (Fase 4: unión de células).
El desarrollo de estas cuatro etapas tiene dos consecuencias principales: por un lado, el crecimiento tumoral debido a los nutrientes, el oxígeno y los factores estimulantes (figura 3.a), y por otro, la introducción de células tumorales en los vasos sanguíneos, que por vía sanguínea se extienden a otras partes del cuerpo y provocan nuevos tumores (figura 3.b).
Inhibición de la angiogénesis tumoral
Actualmente es conocida la relación entre la vitalidad de la angiogénesis tumoral, la frecuencia de metástasis y la reducción de la esperanza de vida de los pacientes (Pluda, 1997). Por ello, la inhibición efectiva de la angiogénesis se ha convertido en el objetivo de muchos científicos. Sobre todo, evitar la formación de nuevos vasos sanguíneos, ya que además de inhibir la metástasis, reducirá el tamaño del tumor, facilitando la erradicación del cáncer mediante quimioterapia o cirugía.
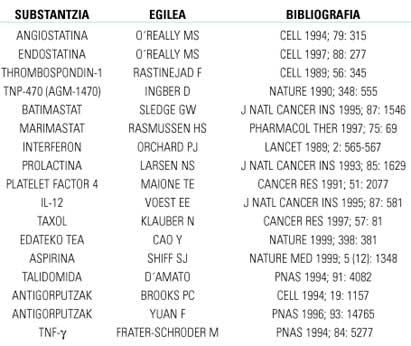
Teniendo en cuenta lo anteriormente expuesto, una forma sencilla de inhibir la angiogénesis sería dirigirla hacia los equilibrios reguladores negativos de los factores. Esto se puede conseguir de dos formas: inhibiendo los factores positivos o fomentando los negativos. También se puede inhibir cualquier fase de la angiogénesis si se bloquean las enzimas y/o proteínas implicadas. En la tabla 1 se muestran los fármacos más eficaces contra la angiogénesis investigados en animales de laboratorio. De ellos, sólo los que mejores resultados y más seguridad ofrezcan intentarán en humanos con sesiones clínicas.
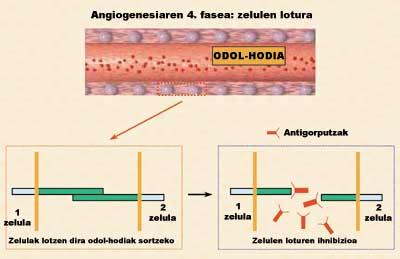
De las cuatro fases de la angiogénesis, una de las más interesantes es la que menos se ha estudiado desde un punto de vista terapéutico. Por ello, el laboratorio de Farmacia y Tecnología Farmacéutica de la Facultad de Farmacia (UPV/EHU) inició un nuevo estudio de inhibición de la angiogénesis para bloquear esta cuarta fase. El objetivo de la investigación fue inhibir algunas proteínas adhesivas que permiten la unión entre células endoteliales. Para inhibir o bloquear estas proteínas se utilizaron células que segregaban anticuerpos específicos (Figura 4). Sin embargo, si las células se administraran como tales, eliminaría rápidamente los sistemas inmunológicos de los animales por considerarlos desconocidos.
Para solucionar este problema, los agrupamos en esferas poliméricas de pequeño tamaño que protege las células frente al sistema inmunológico. Este proceso se conoce como microencapsulación celular (Orive G, 2000). Dentro de estas pequeñas cápsulas, las células, además de crecer, segregaban el anticuerpo que nos interesaba. Esta nueva estrategia anti-angiogénesis tiene dos ventajas principales: por un lado, la inhibición de una proteína poco estudiada y por otro, la secreción continuada y prolongada de anticuerpo por parte de las células.
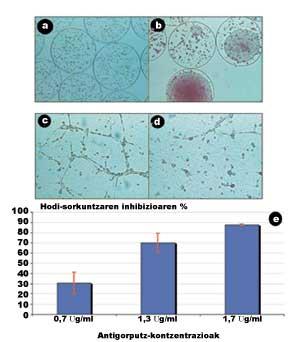
En la figura 5 se presentan algunos de los resultados obtenidos en este estudio (Orive G, 2001). En las siguientes imágenes, obtenidas mediante el microscopio, se observa que las células crecen y se dividen rápidamente en el interior de las cápsulas, dando lugar a la formación de agregados violentos (Figuras 5.a y 5.b).
En otra sesión analizamos la capacidad de los anticuerpos segregados para bloquear la unión entre células endoteliales. Para ello, las células endoteliales fueron estimuladas por factores de crecimiento. Estos factores estiraron las células y facilitaron las uniones entre ellas, creando vasos sanguíneos inmaduros (tubulos), es decir, estructuras previas a los vasos sanguíneos que alimentarán el tumor. Como se observa en la figura 5.c, en ausencia de anticuerpos, las relaciones entre células endoteliales son muy notables.
Por el contrario, cuando se introdujo la disolución de anticuerpos con una concentración de 1,7 µg/ml, las uniones intercelulares y, por tanto, la formación de tubulos se inhibieron casi por completo (Figura 5.d). ¿Cuál es su significado? Que el anticuerpo que segregan las células encapsuladas tiene la capacidad de inhibir la angiogénesis y que el bloqueo de proteínas adhesivas es una buena estrategia para inhibir la angiogénesis tumoral. Además, en una última sesión se demostró que la relación entre la tracción concertística anticuerpo y la capacidad de inhibir la angiogénesis es directamente proporcional (Figura 5.e).
Estos esperanzadores resultados iniciales nos han llevado a una nueva investigación en la que utilizaremos la terapia génica como base para inhibir la angiogénesis tumoral.
Fin
A partir de la década de los 90 la angiogénesis se ha ido haciendo cada vez más interesante tanto para los científicos como para la industria. De hecho, más de 25 fármacos contra la angiogénesis están siendo tratados en sesiones clínicas (Kerbel, 2000). El interés actual se centra no sólo en el descubrimiento de nuevos fármacos, sino también en la combinación de estrategias antiangiogénesis y estrategias convencionales contra el cáncer (quimioterapia, radioterapia y cirugía).
Esta última idea tiene una gran importancia teniendo en cuenta que la combinación de varias estrategias puede predecir efectos sinérgicos, es decir, efectos más beneficiosos que los logrados individualmente por dichas estrategias. Además, nuevas estrategias de administración (anticuerpos monoclonales, terapia génica, etc.). ), permiten nuevas soluciones para inhibir la angiogénesis y así controlar los cánceres.
En definitiva, aunque todavía queda mucho por investigar, el trabajo diario y el sueño más dulce de todos los científicos es hacer suyas las malas enfermedades.