Como se limpan as pezas na lavadora?
Un pouco de historia
O xabón utilizouse por primeira vez fai uns 5.000 anos. Os babilonios foron os primeiros en obter o xabón, cocidos en po con varias graxas, que ao parecer utilizábanse paira decorar o cabelo. Desde entón, os jaboneros estiveron presentes nas civilizacións de todos os tempos. En Exipto, por exemplo, hai tempo

3.500 anos, persoas de alto nivel bañábanse asiduamente con graxas animais e vexetais e xabóns a base de sales alcalinas. Tamén os romanos e gregos usaban con frecuencia xabóns paira a limpeza e o medicamento.
Segundo diversas lendas, os romanos deron a palabra xabón ao produto que limpaba tan ben. Parece que no monte Sapo quéimase o gando sacrificado e que as cinzas xeradas posteriormente mestúranse facilmente coas graxas animais vertidas. Non se como, estas mesturas vertíanse ao río Tiber e chegaban ao lugar onde as mulleres lavaban a roupa. Segundo estas mulleres, a roupa limpábase máis facilmente na cima do monte tras verter esta curiosa mestura ao río.
Na Idade Media fabricábase xabón con aceite de oliva en España, Francia e Italia. A produción moderna de xabón comezou en 1811, cando o químico francés Michel Eugene Chevreul investigou as características e química das graxas, os ácidos grasos e a glicerina.
Pero o deterxente é máis novo. Apareceu no mercado por primeira vez en 1907 da man da empresa alemá Persil. Este deterxente, ademais dos xabóns tradicionais, contiña perborato sódico, silicato sódico e carbonato sódico (perborato + silicato = PERSIL).
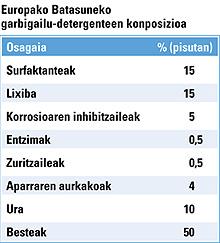
A diferenza máis evidente entre deterxentes e xabóns é a súa orixe. Os deterxentes son sintéticos e obtéñense a partir das fraccións de petróleo. Os xabóns son naturais. A pesar de ser moi bos limpadores, o rendemento dos xabóns diminúe considerablemente en presenza de auga e sales minerais. Os deterxentes, pola súa banda, aumentan nas mesmas condicións.
Mecanismos de limpeza
Paira comprender como se produce a limpeza débese prestar atención á interacción de tres elementos: o de lavado, neste caso o tecido; a sucidade ou mancha, é dicir, o de lavado a 100 (graxa en xeral); e a disolución acuosa na que está disolto o deterxente.
A clave da limpeza está na relación adecuada entre o tres, pero non foi fácil coñecer os detalles da relación. O comportamento dos deterxentes entendeuse grazas á investigación levada a cabo nas últimas décadas, a pesar do centenario da súa primeira utilización. De feito, do mesmo xeito que ocorre con moitos cosméticos, os fabricantes non coñecen a función de moitos compoñentes. Con todo, saben que os produtos serven e cumpren ben o seu labor.
Paira facilitar a explicación do proceso de limpeza pódense dividir os pasos que se dan na lavadora en dous partes. Na primeira, na limpeza do tecido extráense do tecido as pingas de manchas que manchan o tecido. Na segunda, o reto é dobre: conseguir que estas pingas permanezan dispersas en solución de deterxente e non volvan ao tecido. Está claro que a segunda parte é tan importante como a primeira, xa que na segunda, se as cousas non se fan ben, os tecidos seguirán sucios.
Hai que ter en conta que o mecanismo de limpeza non é o único. Hai moitos tipos de tecidos e sucidade, e non todos actúan igual, polo que é imposible atopar una soa teoría ou mecanismo que explique ben o proceso de limpeza.
Se a interacción entre a mancha e o tecido é química, por exemplo, o enlace covalente debe romper mediante unións químicas adicionais entre ambas. Paira iso utilízanse encimas ou lejías. Por exemplo, as encimas proteasa e amilasa rompen as cadeas de almidón e proteínas das manchas de chocolate, leite ou herba, e fragmentan e reducen completamente a mancha. Pero se a mancha e o tecido están adheridos por forzas electrostáticas ou débiles forzas de atracción intermoleculares, o mecanismo de limpeza é totalmente distinto. É o caso das partículas sólidas e as pingas de graxa. Nestes casos utilízanse surfactantes paira axudar ás manchas a sacalas do tecido.
Os surfactantes, tamén chamados moléculas tensioactivas, son un dos compoñentes máis importantes dos deterxentes e teñen varias obrigacións. Reducen a tensión superficial do tecido e da mancha e reducen o traballo de extracción da mesma do tecido; ademais, os surfactantes tenden a colocarse sobre a superficie da mancha, polo que a emulsionan con gran facilidade na auga. Por último, as pingas de graxa protéxense ben unas doutras paira evitar que volvan unirse.
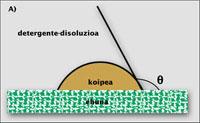
Se a mancha é líquida, o proceso de limpeza pode explicarse matematicamente dunha forma sinxela. Poñamos una pinga de aceite ou graxa sobre un tecido ou una fibra. A pinga forma un ángulo co tecido, que é o ángulo de contacto (q). Este ángulo indica a dificultade de limpar o tecido: si é pequeno, a superficie de contacto entre a mancha e o tecido é elevada, o que dificulta a súa limpeza. Se o ángulo é alto, ocorre ao revés. É lóxico xa que hai que facer un traballo físico paira levar a gotita de graxa desde a superficie do tecido á solución acuosa.
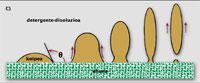
O menor traballo realízase cando o ángulo q entre o tecido e a gotita é 0. Entón, os dous tócanse nun punto e a limpeza é instantánea. Por encima de cero, o traballo só aumenta. Con todo, se o ángulo é menor de 90º (B), a cuestión non é tan complicada, xa que a axuda dos surfactantes adoita ser suficiente paira sacar a mancha do tecido. Con todo, se o ángulo oscila entre 90º e 180º (C), só una parte da pinga de aceite abandona o tecido e a roupa permanece sucia ao saír da lavadora. Neste caso, o lavado da roupa require outro mecanismo, como a disolución de pingas de aceite.
Una vez limpa, protexer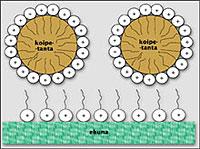
Una vez extraídas as gotitas de manchas do tecido, débense manter dispersas na auga para que a limpeza non sexa un traballo de desalento. Paira iso hai que protexer as pingas do tecido e o tecido das pingas. Neste proceso tamén é imprescindible a colaboración dos surfactantes.
Os surfactantes tenden a colocarse sobre as superficies das pingas e tecidos de graxa, proporcionando a ambas as superficies o mesmo tipo de carga. En consecuencia, as forzas de repulsión permiten que as pingas das manchas non coincidan entre si e mantéñanse o máis afastadas posible do tecido. Ademais de provocar repulsión eléctrica, as moléculas tensoactivas tamén interferen fisicamente con cadeas de alto peso molecular. As moléculas tensoactivas tamén se colocan nas superficies do tecido e da pinga de graxa, e as súas cadeas longas e rizadas axudan a manter as superficies afastadas entre si.
ExtrasComo aditivos utilízanse polímeros e outros produtos. A carboxil celulosa sódica, por exemplo, una vez limpadas as fibras de celulosa, crea una capa protectora na superficie da fibra que impide a reposición das pingas de graxa.
Os deterxentes conteñen compoñentes que non teñen como obxectivo escorrentar a mancha. Os silicatos e fosfatos, por exemplo, melloran o rendemento dos deterxentes, formando complexos solubles cos iones Ca+2 e Mg+2 presentes na auga paira evitar a formación de sedimentos calcáreos nas tubaxes de auga. Con todo, o seu impacto sobre o medio ambiente vese afectado pola procura de aditivos que substitúan aos fosfatos nos últimos anos.
Os colorantes fluorescentes achegan mellor brillo e aspecto á roupa branca. Absorben a luz ultravioleta e emiten unha cor azul claro que, grazas a este truco, oculta o amargo que pode ter a roupa.
Una vez feito todo este camiño, a roupa debería saír limpa da lavadora e, a pesar de que haxa moitas melloras —todos coñecemos una mancha que parece pegarse una vez a unha peza e quedar nela paira sempre—, normalmente é así. Aí dentro, máis que un milagre, hai moito en xogo a química.
Materiais que se limpan sen xabón


Algúns químicos alemáns, copiando as características da folla da planta lotus, desenvolveron pedras, papel ou tecidos que só se limpan. As follas de Lotus son superhidrófobas (odio en grego á auga), onde as pingas de auga escorréganse totalmente. Mesmo en días chuviosos as follas mantéñense completamente secas. Esta delicadeza é moi interesante, xa que as pingas de choiva arrastran a sucidade que se atopa encima das follas (po, pole, etc.). ).
O botánico Wilhelm Barthlott descubriu o porqué a principios dos 90. As follas de lotus deben a súa acidez aos picores de 5-10 micrómetros de superficie. As almofadas permiten que as pingas de auga só estean en contacto coa superficie das follas nalgúns puntos e non poidan quedar sobre elas. Caen pola súa conta.
Na imaxe da esquerda aparecen dúas superficies superhidrófobas non naturais. En ambos os casos, as pingas que se deslizarán con facilidade son perfectamente redondas. Estas superficies poden, por tanto, limparse sen xabón ou aditivo, só grazas ao movemento da pinga. O efecto da folla de lotus conséguese mediante o tratamento químico das superficies. O método foi patentado polo propio Barthlott con márcaa Efecto Lotus (BASF) e xa se utilizou paira limpar fachadas.
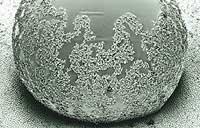
O efecto Lotus permite modificar as características superficiais de moitos materiais e facilita moito a limpeza. Como se pode apreciar na imaxe, as pingas de auga, a medida que se moven e caen, recollen o po e a sucidade e lévanas consigo.
Suavizantes téxtiles

Os suavizantes téxtiles tamén teñen una gran importancia no proceso de limpeza. Son un dos compoñentes dos deterxentes de roupa, pero a miúdo engádense os tecidos despois de limpalos. Os compoñentes activos dos suavizantes son surfactantes. Péganse sobre a superficie dos tecidos, colocando as cabezas con carga positiva cara ao tecido negativo na auga e as colas cara ao exterior. Producen na superficie das fibras téxtiles una capa suave que, ademais de protexer as fibras, confire á roupa una consistencia suave.
BIBLIOGRAFÍA
- Kaoru Tsujii Surface Activity, Principles, Phenomena and Applications, Academic Press (1998).
- D. J. Shaw Introduction to Colloid and Surface Chemistry, 4th Ed, Butterworth-Heinemann Ltd (1992).
- Efecto Lotus: Ou.E. Erbil, S.L. Demirel, et ao. Science 299, 1377, 2003.
Grazas a Idurre Furones polas súas emendas.