Miles de millones para detectar

Cuando observan el agua, los ojos humanos ven un líquido transparente. Pero si miramos con los ojos pequeños de los químicos todo cambia. El agua no es agua, sino una compleja mezcla de millones de sustancias químicas. Del mismo modo, el vino no es vino, un trozo de queso no es queso y un deportista no es un deportista. Son mezclas de muchas moléculas.
El caso del agua está indicado, por ejemplo, en la etiqueta de las botellas de agua. Además del agua, el líquido contiene iones de cloruro, sulfatos, nitratos, etc., y muchas otras sustancias que no se especifican en la etiqueta. Y a veces también están representados los iones que no se consideran en el agua. "Agua sin sodio". ¿Qué significa eso? ¿Que no hay ningún ion de sodio? Normalmente no, significa que el sodio, si existe, no es detectable. En la práctica es lo mismo, lo que no se puede detectar no existe. Pero quizás el problema sea la técnica utilizada para el análisis.
Los químicos no detectan una sola molécula. No pueden. Ni dos moléculas; o diez; o mil. Deben contener al menos mil millones de moléculas para detectar una sustancia. Parece mil millones, pero es una tontería si hablamos de moléculas. Hay muchas más moléculas en casi cualquier lugar.
Pequeños y numerosos
Un ejemplo es un ensayo lleno de agua. La molécula de agua es pequeña, pero muy abundante. Para poder visualizar las moléculas de agua, deberíamos multiplicar la sesión por diez millones de veces, de diez centímetros a mil kilómetros como mínimo. Si uno de los extremos de un programa de este tamaño estuviera en Bilbao, por ejemplo, el otro estaría en Cádiz, aproximadamente. Si las moléculas de agua aumentaran en la misma proporción, tendrían una longitud de dos milímetros. Eso sí, sería difícil separar las moléculas porque se moverían muy rápido. Pero sirve para hacer una idea: piensa cuántos moléculas de dos milímetros entran en un ensayo de mil kilómetros de longitud.
El físico Amadeo Avogadro encontró la cantidad: 18 mililitros de agua a 6,023 x 10 23 moléculas, casi un cuatrilión. Un millón tiene seis ceros y un billón tiene doce ceros, mientras que el número de Avogadro, redondeado, tiene veintitrés ceros. Es un número muy grande; si se elimina una gota de un billón de moléculas, parece que no se notaría el cambio (en una gota de agua hay aproximadamente diecisiete moléculas de trillón).
La verdad es que la molécula del agua es muy pequeña, las moléculas orgánicas son mucho más grandes y sin embargo ocurre lo mismo: si a una loncha de jamón se le quita un billón de moléculas, el dueño no sería consciente de lo perdido. En este sentido, la detección de mil millones de moléculas parece un milagro.
Separación de moléculas
Siguiendo el mismo ejemplo de agua, se puede analizar el problema del límite de detección. Imaginad que en esta selva de moléculas de agua se mezclan átomos de plomo, es decir, que el agua está contaminada a una concentración de 50 ppm (50 gramos de plomo en un millón de gramos de muestra). Conociendo los pesos del agua y del plomo, se puede estimar que existen alrededor de 231.100 moléculas de agua por cada átomo de plomo. Además, las moléculas de agua son más grandes que los átomos de plomo. Por lo tanto, la detección de plomo parece casi imposible. ¿Cómo se puede hacer?
Está claro que ver moléculas no es el método de detección adecuado --y si existen técnicas de visualización-, ya que en este caso, además de localizar átomos de plomo, habría que saber cuántas moléculas de agua corresponden a cada una de ellas.
Pero también se puede hacer otra cosa: antes de empezar a detectar, dividir las moléculas en grupos. Depende del tamaño, de la carga eléctrica, del comportamiento químico, etc. Una vez divididas las moléculas en grupos, cada grupo tendrá menos moléculas que identificar y se podrá realizar una detección más detallada que con la muestra inicial.
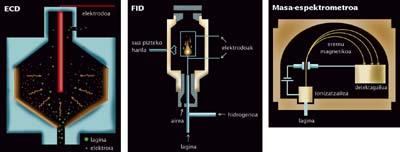
Es lo que se hace en los métodos de detección más precisos existentes en la actualidad: mezclar la muestra con un líquido o un gas e introducirla en un cromatógrafo. El cromatógrafo es una herramienta de separación molecular en la que las moléculas tienen que realizar un recorrido lleno de "trabas"; unas moléculas forman el recorrido rápidamente y otras se ven costadas. A la salida del recorrido, las moléculas aparecen divididas en grupos en función del tiempo que han tenido que completar el recorrido. La instalación de un detector en esta salida permite realizar análisis a cada grupo a medida que salga.
Líquido o gas
Cuanto mayor sea la distribución, más preciso es el análisis posterior. Se trata de averiguar qué cromatógrafo hará la mejor separación. La duda se produce entre el cromatógrafo de gases y líquidos. Se cree que la mezcla de la muestra con el gas y la gasificación de la propia muestra es mejor opción que la mezcla con el líquido. En definitiva, una muestra de un determinado volumen contiene menos moléculas si se trata de gas.
Pero, como en todo, puede haber problemas. No todas las moléculas son aptas para estar en estado gaseoso, por ejemplo si son muy grandes. Además, para transformarla en gas es necesario calentar la muestra y no todas las moléculas superan este proceso: se degradan mucho antes de evaporarse. En este sentido, el líquido es más útil. Una disolución es sencilla al seleccionar el disolvente apropiado.
Por tanto, dependiendo de la sustancia a detectar, la distribución se realiza mediante un cromatógrafo u otro. Lo mismo ocurre con los detectores. Elegir la más adecuada en función de la sustancia a detectar. Algunos detectores son muy especializados, sirven para detectar una determinada sustancia, pero con otros no son precisos o no sirven.
En el ranking de detección de las menores cantidades de sustancias, en la actualidad hay que citar tres: FID, ECD y espectrómetro de masas. Detrás de estos nombres se encuentran los detectores más precisos del mundo, los mejores detectores que existen para buscar trazas moleculares. Los tres se utilizan conjuntamente con cromatógrafos de gases. Pero no siempre. La pareja formada por el espectrómetro de masas y la cromatografía de líquidos también está alcanzando un gran éxito en los últimos tiempos.

Inexacta
Cuatro métodos ofrecen resultados sorprendentes. Por diferentes motivos es difícil comparar los cuatro, pero si tuviéramos que elegir el más llamativo sería el cromatógrafo de gases/par ECD. El detector ECD es un detector extremadamente preciso: puede detectar sólo algunos piccogramas de una sustancia (un pícogramo es el de un billón de un gramo). Si, por ejemplo, la utilizáramos para detectar el cloruro de vinilo, bastarían alrededor de mil millones de moléculas para detectar ECD.
Las parejas que forman los FID y el espectrómetro de masas con cromatógrafo de gases son menos precisas. Los nanogramos "sólo" llegan a detectarse, por ejemplo, necesitan un billón de moléculas para encontrar las huellas del cloruro de vinilo.
¿Y qué éxito tiene el cromatógrafo de líquidos? Normalmente, en lugar de dar el peso que el cromatógrafo puede detectar, los vendedores dan concentración. Los datos más optimistas son sorprendentes: algunos equipos son capaces de encontrar concentraciones de 500 granulomas por litro, es decir, manteniendo el ejemplo del cloruro de vinilo, detectarían diez millones de moléculas en un litro de disolución.
Versión de usuario

Los números deben tomarse con mucho cuidado. Estos datos son datos de los vendedores que indican los límites de detección del método. Pero la realidad siempre es más compleja.
Cada método proporciona límites de detección en determinadas condiciones. Y mediante la medición de determinadas moléculas. El detector ECD es muy bueno con sustancias halogenadas (por eso el cloruro de vinilo es un buen ejemplo por su contenido en cloro). Por su parte, el FID detecta moléculas carbonadas (muchas son pero muchas no contienen carbono).
Sin embargo, también se puede decir lo contrario. Las técnicas actuales satisfacen la necesidad social de precisión en la detección de sustancias.