Destination: moteurs moléculaires
L'ADN du virus commence à donner des ordres quand il entre dans une cellule auberge et met à sa disposition les machines de cellules. Par conséquent, les virus n'ont besoin que d'ADN pour avancer. Bande, ADN et un couvercle ou un capside pour la protéger.
Les cellules hôtelières, d'une part, réalisent plusieurs copies de cet ADN du virus et, d'autre part, de la cellule. L'ADN entre à l'intérieur de la cellule dans une prochaine étape, et c'est alors que les nouveaux virus sont prêts à quitter cette cellule et à attaquer les autres. « En une demi-heure de virus, quatre-vingts virus se produisent », explique Carlos Bustamante, biophysique de l'Université de Californie.
En particulier, Bustamante parle du virus phi-29, qui depuis dix ans étudient dans son laboratoire. L'automne dernier, Atom by Atom a visité Saint-Sébastien, où il a exposé ses recherches sur ce virus.
Le virus Phi-29 est un virus qui attaque les bactéries, mais son comportement ressemble beaucoup à d'autres virus qui nous affectent humains comme la polyomélite, l'herpès ou la varicelle. Par conséquent, les mécanismes observant dans un et les stratégies de prévention de la maladie peuvent servir, probablement, pour d'autres.
Le moteur comme destination
Dans ce cas, les chercheurs se sont concentrés sur le mécanisme qui relie le virus, c'est-à-dire le mécanisme qui introduit l'ADN dans la cellule, dans lequel interviennent de petits moteurs moléculaires, de petites machines à l'échelle nano, qui donnent cette étape indispensable à la formation du virus.
« Si nous réussissons à éliminer ces moteurs, nous empêcherons la formation de virus », explique Bustamante. De cette façon, les infections virales pourraient être combattues de manière radicale. Mais pour atteindre cet objectif, il est pratique de connaître au maximum le moteur.

Pour mettre l'ADN du virus dans la cellule, explique Bustamante, « le moteur doit faire un excellent travail ». En fait, l'ADN doit compacter six mille fois son volume en liberté. "Trop de spaghettis pour une si petite tête", affirme-t-il.
Le moteur a une forme annulaire pour que de la place centrale l'ADN soit introduit dans la capsa. Il s'agit d'un moteur formé par plusieurs groupes de protéines et d'enzymes, parmi lesquels se trouve le noyau de tout ce travail ou, comme l'a dit Bustamante, "les vrais pistons de ce moteur". Il s'agit d'un ensemble de cinq ATPasas. Les ATPases sont capables de casser un certain lien des molécules d'ATP ; en les cassant, l'énergie est libérée et avec cette énergie, les ATPas modifient la conformation. Autrement dit, les ATP convertissent l'énergie chimique en énergie mécanique, de même que les pistons des moteurs conventionnels.
Dans ce changement de formage, les ATPasas se contractent vers l'intérieur de la cellule et avec ce mouvement le moteur l'introduit dans la capsa ADN.
Goliath face à face
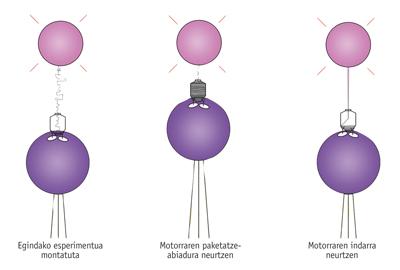
En connaissant son fonctionnement, Bustamante et ses compagnons ont voulu aller plus loin et connaître ses "spécifications techniques". C'est-à-dire qu'ils voulaient savoir quelle force il a, à quelle vitesse il met l'ADN dans la cellule, etc. Pour ce faire, ils ont agi en quelque sorte sur la "sokatira" avec le virus, c'est à dire qu'ils ont attrapé la cellule et l'ADN par les deux extrémités et mesuré les forces.
En moyenne, on a observé que le virus introduit 100 paires de bases par seconde dans la cellule. Cependant, la vitesse diminue à mesure que l'ADN s'accumule dans la cellule, en raison de la pression interne croissante de celle-ci.
En diminuant la vitesse, ils ont vu que la force nécessaire pour effectuer ce travail est de plus en plus grande. Comme l'a décrit Bustamante, « ce moteur est équivalent au Goliath parmi les moteurs moléculaires, le moteur le plus puissant jamais mesuré ». En fait, lorsque vous avez la plupart de l'ADN à l'intérieur, c'est à dire quand vous devez faire la plus grande force, le moteur peut arriver à faire une force du piconewton 57-60. « C'est une force énorme », affirme Bustamante, et l'a comparée à la capacité d'autres moteurs moléculaires. "Par exemple, la myosine qui permet la contraction de nos muscles a également ATPasas, mais chacun d'eux ne peut exercer une force de cinq piconewtons".
Avec une telle force, l'ADN s'accumule dans la cellule à 60 atmosphères. Par exemple, le champagne se trouve à 5-6 atmosphères de pression dans les bouteilles.
Bien sûr, pour faire toutes ces forces, les virus doivent gaspiller beaucoup d'énergie ; « si la cellule avait une double taille, par exemple, ils économiseraient beaucoup d'énergie », explique Bustamante. Mais « le but du virus n'est pas d'économiser de l'énergie », dit-il. En bref, cette énergie qui utilise le moteur ne doit pas être générée par le virus, est détenue par la cellule hôte, de sorte que "il ne se soucie pas de gaspiller l'énergie".
Et en outre, tout cela est utile pour le virus. Les nouveaux virus, en sortant de la cellule hôte, passent à un milieu sans ATP : l'intercellulaire. Ils n'ont pas accès à l'énergie, et c'est alors qu'ils profitent de toute l'énergie dissipée dans la cellule hôte : quand ils arrivent à une autre cellule hôtelière, ils injectent l'ADN qu'ils ont stocké à une pression de 60 atmosphères. « Cette énergie potentielle se transforme en énergie cinétique et introduit sous pression l'ADN dans la nouvelle cellule hôtelière », explique Bustamante. Selon lui, « c'est une stratégie très élégante ».
Contre les virus et plus
Connu tous ces détails du moteur moléculaire, il est évident qu'une stratégie anti-virus très efficace pourrait être obtenue en arrivant à éliminer les moteurs moléculaires.
« Mais il ne suffit pas d'étudier la mécanique des moteurs moléculaires », explique Itziar Alkorta, professeur au Département de biochimie et de biologie moléculaire de l'UPV. « La recherche qu'ils ont menée est certainement importante, mais si l'on veut concevoir un médicament pour éliminer ce groupe de protéines, il est nécessaire d'effectuer des études biochimiques pour connaître les caractéristiques des protéines et ainsi choisir des composés qui peuvent les combattre », a ajouté Alkorta.
Alkorta réalise précisément des études biochimiques avec un autre moteur moléculaire. Ce moteur n'est pas associé à des virus mais à des bactéries. "Nous recherchons un moteur moléculaire qui participe à la conjugaison des bactéries". L'objectif final de ce groupe de chercheurs est d'éliminer la conjugaison, entre autres parce que la résistance aux antibiotiques se propage à travers la conjugaison. La conjugaison est l'échange d'ADN observé dans les bactéries, à travers lequel les bactéries partagent beaucoup d'informations.
Une fois que vous avez toutes les informations nécessaires et connaissez en détail tous les aspects à connaître sur les moteurs moléculaires, il sera plus facile de développer des médicaments contre les moteurs. « Le plus difficile est de connaître la machine d'un système concret, c'est-à-dire comment elle fonctionne au niveau moléculaire », explique César Martin, un autre membre du même département de l'UPV. Ensuite, avec cette information, il est "facile" de rechercher des moyens pour supprimer le système. Alkorta partage cette opinion: "Ce n'est pas quelque chose qui est obtenu d'un jour à l'autre, mais ce n'est pas une tâche difficile".
Mais même si ce n'est pas difficile, c'est quelque chose à contrôler avec beaucoup de soin. En fait, "la tentative de ralentir le moteur du virus pourrait également risquer d'arrêter les moteurs des cellules saines", a souligné Alexander Bittner, chef du groupe d'auto-assemblage CIC nanoGUNE.
En plus d'agir contre eux, la connaissance approfondie des mécanismes des moteurs moléculaires peut permettre de concevoir des outils biotechnologiques à échelle nano par imitation. En définitive, dans tous les processus cellulaires liés au mouvement, comme le mouvement des flagelles, la duplication cellulaire et la contraction musculaire, un certain moteur moléculaire est impliqué. Par conséquent, nous pouvons imiter n'importe quel système de ce type quand nous apprenons à imiter ou manipuler des moteurs, et nous serons capables de fournir des moteurs qui rendent mobiles aux cellules immobiles ou aux machines d'échelle nano.
Par exemple, ils peuvent être utilisés pour les thérapies géniques. "Les thérapies géniques consistent essentiellement à introduire un morceau d'ADN dans certaines cellules pour éviter un processus qui se produit dans la cellule grâce à cet ADN ou, au contraire, pour stimuler quelque chose qui ne se passe pas." De nombreux virus modifiés sont utilisés comme vecteurs pour introduire l'ADN dans les cellules. Mais ce serait beaucoup plus efficace que nous ne pouvions utiliser que des moteurs moléculaires, car nous pourrions pomper l'ADN directement à l'intérieur des cellules.
Cependant, ces objectifs ou applications sont encore trop loin. « J'aime avoir les pieds sur le sol, et c'est à l'avenir ; aujourd'hui on n'a pas réussi à le faire, que je sache », dit Alkorta. Cependant, il souligne que ce n'est pas un peu: Avant ou après, nous allons travailler avec ce type de système. Nous allons sur le chemin".