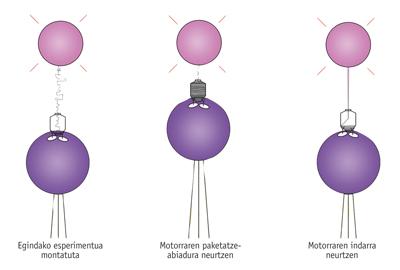
Destinació: motors moleculars
L'ADN del virus comença a donar ordres quan entra en una cèl·lula hostal i posa a la seva disposició la maquinària de la cèl·lula. Per tant, els virus només necessiten ADN per a avançar. Tira, ADN i una tapa o càpside per a protegir-la.
Les cèl·lules hostaleres, d'una banda, realitzen diverses còpies d'aquest ADN del virus i, per un altre, de la càpsida. L'ADN entra a l'interior de la càpsida en un següent pas, i és llavors quan els nous virus estan disposats a sortir d'aquesta cèl·lula i atacar a uns altres. "En mitja hora d'un virus es produeixen vuitanta virus", explica Carlos Bustamante, biofísic de la Universitat de Califòrnia.
En concret, Bustamante parla del virus phi-29, que des de fa deu anys estan investigant en el seu laboratori. La passada tardor, Atom by Atom va visitar Sant Sebastià, on va exposar les seves recerques sobre aquest virus.
El virus Phi-29 és un virus que ataca als bacteris, però el seu comportament s'assembla molt a altres virus que ens afecten els éssers humans com la poliomelitis, l'herpes o la varicel·la. Per tant, els mecanismes que observen en un i les estratègies de prevenció de la malaltia poden servir, probablement, per a uns altres.
El motor com a destinació
En aquest cas, els investigadors s'han centrat en el mecanisme que assemblen el virus, és a dir, el mecanisme que introdueix l'ADN dins de la càpsida, en el qual intervenen uns petits motors moleculars, unes petites màquines a escala nano, que fan aquest pas imprescindible per a la formació del virus.
"Si aconseguim eliminar aquests motors, evitaríem que es formessin virus", explica Bustamante. D'aquesta manera es podrien combatre de manera radical les infeccions dels virus. Però per a arribar a aquest objectiu és convenient conèixer al màxim el motor.

Segons explica Bustamante, per a ficar l'ADN del virus en la càpsida, "el motor ha de fer una gran feina". De fet, l'ADN ha de compactar sis mil vegades el seu volum en llibertat. "Massa espaguetis per a un cap tan petit", afirma.
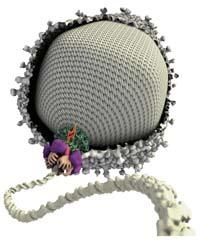
El motor té forma anul·lar perquè des del buit central es vagi introduint l'ADN en la capsa. Es tracta d'un motor format per diversos grups de proteïnes i enzims, entre els quals es troba el nucli de tot aquest treball o, com ha dit Bustamante, "els veritables pistons d'aquest motor". Es tracta d'un conjunt de cinc ATPasas. Les ATPasas són capaces de trencar un determinat enllaç de les molècules d'ATP; en trencar-les, s'allibera energia i amb aquesta energia, les ATPas modifiquen la conformació. És a dir, els ATPs converteixen l'energia química en energia mecànica, igual que els pistons dels motors convencionals.
En aquest canvi de conformat, les ATPasas es contreuen cap a l'interior de la càpsida i amb aquest moviment el motor l'introdueix en la capsa ADN.
Goliat cara a cara
En conèixer el seu funcionament, Bustamante i els seus companys van voler anar més enllà i conèixer les seves "especificacions tècniques". És a dir, volien saber quina força té, a quina velocitat fica l'ADN dins de la càpsida, etc. Per a això van actuar d'alguna manera en la "sokatira" amb el virus, és a dir, van agafar la càpsida i l'ADN pels dos extrems i van mesurar les forces.
Com a mitjana es va observar que el virus introdueix 100 parells de bases per segon en la càpsida. No obstant això, la velocitat disminueix a mesura que l'ADN s'acumula en la càpsida, a causa de la creixent pressió interna d'aquesta.
En anar disminuint la velocitat, van veure que la força necessària per a fer aquest treball és cada vegada major. Com va descriure Bustamante, "aquest motor és equivalent al Goliat entre els motors moleculars, el motor més potent mai mesurat". De fet, quan té la major part de l'ADN en el seu interior, és a dir, quan ha de fer la major força, el motor pot arribar a fer una força del piconewton 57-60. "És una força enorme", afirma Bustamante, i la va comparar amb la capacitat d'altres motors moleculars. "Per exemple, la miosina que permet la contracció dels nostres músculs també té ATPasas, però cadascuna d'elles només pot exercir una força de cinc piconewtons".
Amb tanta força l'ADN s'acumula en la càpsida a 60 atmosferes. Per exemple, el xampany es troba a 5-6 atmosferes de pressió en les ampolles.
Per descomptat, per a fer totes aquestes forces, els virus han de dilapidar un munt d'energia; "si la càpsida tingués una doble grandària, per exemple, estalviarien molta energia", explica Bustamante. Però "l'objectiu del virus no és estalviar energia", diu. En definitiva, aquesta energia que utilitza el motor no ha de ser generada pel virus, és propietat de la cèl·lula hoste, per la qual cosa "no li importa malbaratar energia".
I a més, tot això és útil per al virus. Els nous virus, en sortir de la cèl·lula hoste, passen a un mitjà sense ATP: l'intercel·lular. Allí no tenen accés a l'energia, i és llavors quan aprofiten tota l'energia dissipada en la cèl·lula hoste: quan arriben a una altra cèl·lula hostalera li injecten l'ADN que tenen emmagatzemat a una pressió de 60 atmosferes. "Aquesta energia potencial es transforma en energia cinètica i introdueix sota pressió l'ADN en la nova cèl·lula hostalera", explica Bustamante. En la seva opinió, "és una estratègia molt elegant".
Contra els virus i més
Coneguts tots aquests detalls del motor molecular, és evident que una estratègia anti-virus molt eficaç podria aconseguir-se en arribar a eliminar els motors moleculars.
"Però per a això no n'hi ha prou amb estudiar la mecànica dels motors moleculars", explica Itziar Alkorta, professora del Departament de Bioquímica i Biologia Molecular de la UPV. "Sens dubte és important la recerca que han realitzat, però si es vol dissenyar un medicament per a eliminar aquest grup de proteïnes, és necessari realitzar també estudis bioquímics per a conèixer les característiques de les proteïnes i poder així triar compostos que puguin combatre-les", ha afegit Alkorta.
Precisament, Alkorta realitza estudis bioquímics amb un altre motor molecular. Aquest motor no està associat a virus sinó a bacteris. "Estem investigant un motor molecular que participa en la conjugació de bacteris". L'objectiu final d'aquest grup d'investigadors és arribar a eliminar la conjugació, entre altres coses perquè la resistència als antibiòtics es propaga a través de la conjugació. La conjugació és l'intercanvi d'ADN observat en els bacteris, a través del qual els bacteris comparteixen molta informació.
Una vegada que disposin de tota la informació necessària i coneguin detalladament tots els aspectes que han de conèixer-se sobre els motors moleculars, serà més fàcil desenvolupar medicaments contra els motors. "El més difícil és conèixer la maquinària d'un sistema concret, és a dir, com funciona a nivell molecular", explica César Martín, un altre membre del mateix departament de la UPV. Després, amb aquesta informació, és "fàcil" buscar vies per a eliminar el sistema. Alkorta comparteix aquesta opinió: "No és alguna cosa que s'aconsegueix d'un dia per a un altre, però no és una tasca difícil".
Però encara que no és difícil, és alguna cosa que cal controlar amb molta cura. De fet, "l'intent de frenar el motor del virus també podria córrer el risc de detenir els motors de les cèl·lules sanes", ha destacat Alexander Bittner, cap del grup d'autoensamblajes de CIC nanoGUNE.
A més d'actuar contra ells, el coneixement exhaustiu dels mecanismes dels motors moleculars pot permetre idear eines biotecnològiques a escala nano per imitació. En definitiva, en tots els processos cel·lulars relacionats amb el moviment, com el moviment dels flagels, la duplicació cel·lular i la contracció muscular, està involucrat algun motor molecular. Per tant, podrem imitar qualsevol sistema d'aquest tipus quan aprenguem a imitar o manipular motors, i serem capaços de proveir de motors que facin mòbils a cèl·lules immòbils o màquines d'escala nano.
Per exemple, es podran utilitzar per a teràpies gèniques. "Les teràpies gèniques consisteixen bàsicament a introduir un tros d'ADN en determinades cèl·lules per a evitar un procés que s'està produint en la cèl·lula gràcies a aquest ADN o, per contra, per a impulsar alguna cosa que no està ocorrent". En moltes ocasions s'utilitzen virus modificats com a vectors per a introduir l'ADN dins de les cèl·lules. Però seria molt més eficaç que només poguéssim utilitzar motors moleculars, ja que seríem capaços de bombar l'ADN directament a l'interior de les cèl·lules.
No obstant això, aquests objectius o aplicacions encara estan massa lluny. "Jo m'agrada tocar de peus a terra, i això està en el futur; avui no s'ha aconseguit fer això, que jo sàpiga", diu Alkorta. No obstant això, destaca que no és poc: "Abans o després, aconseguirem treballar amb aquesta mena de sistemes. Anem en el camí".