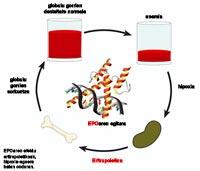
Posibilidad de EPO mediante células encapsuladas
Farmazian doktorea. Biofarmazia, Farmakozinetika eta Farmazia-teknologiako irakasle kolaboratzailea
Farmazia Fakultatea UPV-EHU, Vitoria-Gasteiz
La anemia se debe, principalmente, a la escasez o ausencia total de una hormona denominada eritropoyetina (EPO). Esta hormona promueve la creación de glóbulos rojos. Se segrega en riñones, hígado, útero, células musculares, células endoteliales y células productoras de insulina, dependiendo del grado de oxígeno de los tejidos. Precisamente cuando se reduce el nivel de oxígeno de los tejidos se fluye el factor regulador HIF-1, lo que aumenta considerablemente la producción de EPO.
La secreción de las hormonas EPO en cantidades adecuadas es fundamental. Esto se debe a que si se segrega menos de lo que corresponde, el número de glóbulos rojos en la sangre es menor de lo suficiente y, por lo tanto, existe el riesgo de que los pacientes sufran una serie de alteraciones como la fatiga, la hipoxia tisular, la menor tolerancia al deporte y la hipertrofia cardiaca, el aumento del tamaño de los tejidos del corazón.
La opción más eficaz para tratar todas estas alteraciones es la de tomar la EPO. Actualmente en el mercado se encuentra el medicamento con EPO recombinante humano. Los pacientes con anemia crónica reciben esta hormona 2 o 3 veces por semana, aproximadamente entre 1.000 y 9.000 unidades por semana. Por otra parte, recientemente se ha publicado con el nombre de Darbepoetina una derivada de la EPO: eritropietina. La principal ventaja de este nuevo derivado es su duración. Su persistencia en el organismo es prolongada, por lo que su frecuencia es mucho menor.
Sin embargo, la importancia y el gran interés de la eritropoyetina no se limitan a la anemia. Estudios recientes indican que la EPO puede ser eficaz para el tratamiento de otras enfermedades crónicas como la talasemia, la artritis o el mieloma. Además, puede ser útil en alteraciones del sistema nervioso central, como las enfermedades de Parkinson o Alzheimer, y en isquemias cerebrales (cuando se interrumpe el suministro de sangre en el cerebro) debido a propiedades antiinflamatorias y neuroprotectoras.
Por otra parte, diversos estudios han demostrado que la hormona EPO es capaz de modular la intensidad de la respuesta inmunológica y es también angiogénica, es decir, promueve la formación de vasos sanguíneos.
Por todo ello, es fácil comprender el interés de muchos grupos de investigación y empresas biotecnológicas por investigar en profundidad la molécula de EPO y por desarrollar nuevos fármacos con ella. El objetivo de estos esfuerzos es mejorar las propiedades de la hormona para tratar eficazmente estas enfermedades.
Células musculares que segregan EPO
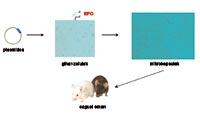
Dadas las propiedades y características de la hormona EPO, se ha comenzado a trabajar en el desarrollo de una nueva estrategia de administración de EPO en el laboratorio de Farmacia y Tecnología Farmacéutica de Vitoria-Gasteiz. Para cumplir con este objetivo hemos utilizado la tecnología de células microencapsuladas. En primer lugar, hemos fabricado células musculares que segregan EPO, las hemos colocado en cápsulas de diseño y tamaño adecuado, y finalmente hemos donado las células encapsuladas a los animales.
Las cápsulas protegen a las células musculares de la respuesta inmunológica. Hay que tener en cuenta que estas células son extrañas para el organismo y por tanto destruyen los sistemas inmunológicos. Sin embargo, una adecuada preparación de las cápsulas evita la respuesta del sistema inmunológico y, al protegerse en el interior de las cápsulas, las células son capaces de fluir la hormona durante largos periodos de tiempo. En consecuencia, hay que “tomarlas” menos y el tratamiento es más cómodo para el paciente.
Además de todo ello, teniendo en cuenta las propiedades angiogénicas de la EPO y la capacidad de modular la intensidad de la respuesta inmunológica, se realizaron ensayos mediante diferentes formas de administración de cápsulas. Aunque se optó por la vía intraperitoneal tradicional, también se probó la vía subcutánea con malos resultados en general en esta tecnología. Este último camino es mucho más cómodo, por lo que sería de gran interés –y un gran avance para la tecnología- si las cápsulas emitidas por esta vía permitiesen mantener a largo plazo los efectos terapéuticos de la EPO.
Resultados y debate
Las células a suministrar fueron extraídas del ratón tipo C3H y posteriormente transformadas en laboratorio para la secreción de EPO. Estas células transformadas fueron encapsuladas e incorporadas de nuevo a los ratones.
Idealmente, a mayor cantidad de productos terapéuticos que fluyen las células, menor número de células y, en definitiva, menor cantidad de cápsulas a incorporar a los animales para un mismo efecto farmacológico. Con el fin de lograr un medio idóneo, en cada cápsula se depositaron un máximo de 300-400 células. Posteriormente se prepararon cápsulas de 480 micrómetros y se midió la producción de EPO de las células internas.
Para evitar que tras su implantación se produjera ningún tipo de respuesta inmunológica en los animales, se prepararon cuidadosamente las cápsulas. Los hicimos con alginato depurado, de superficie lisa y del mismo tamaño. Estas características son muy importantes desde el punto de vista de la biocompatibilidad para evitar la respuesta del sistema inmunológico.
Incorporamos las cápsulas a dos tipos de ratón, CH3 y Balb/c. Como las células salieron de las primeras, tienen las mismas características genéticas, pero las segundas no, por lo que su probabilidad de respuesta inmunológica es mayor. La determinación de la dosis a los animales fue un paso crítico. De hecho, si la dosis era excesiva se corría el riesgo de que aparecieran efectos tóxicos, incluso mortales de animales, mientras que si era demasiado pequeña se corría el riesgo de no tener efectos terapéuticos.
Los primeros experimentos se llevaron a cabo en el ratón C3H, para lo cual se dividieron 20 ratones en 4 grupos (un grupo de control por vía y otro en el que se recogieron las cápsulas por vía). Para conocer las emisiones de EPO se midió el hematocrito animal, porcentaje de glóbulos rojos en sangre, durante 100 días semanales.
Los resultados muestran claramente que el hematocrito animal aumentó notablemente en ambos grupos, tanto en la recogida de las cápsulas por vía intraperitoneal en los ratones como en la inserción subcutánea de las cápsulas. Los valores del hematocrito fueron, además, superiores al 80% en todo el tiempo, por lo que estadísticamente significativos en comparación con los grupos de control.
Sin embargo, para conocer el verdadero valor de las células microencapsuladas era necesario proporcionar y demostrar su eficacia a los seres vivos que no poseen sus características genéticas. Para ello, realizamos el mismo experimento anterior con 20 ratones tipo Balb/c y los resultados volvieron a ser estadísticamente significativos en todos los casos: el hematocrito animal se mantuvo por encima del 75% durante los 100 días de estudio.
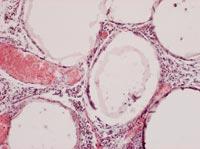
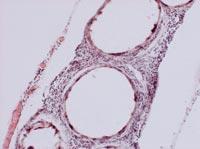
A partir de todos estos datos, sacamos dos conclusiones principales. Por un lado, las cápsulas fueron capaces de frenar o al menos reducir la respuesta inmunológica de los ratones. Por otro lado, la introducción de células bajo la piel puede ser una oportunidad para desarrollar un tratamiento crónico con cápsulas.
Para analizar el estado de las cápsulas, el día 150 se mataron algunos animales de cada grupo y se recuperaron las cápsulas. El estado y estructura de las cápsulas era diferente según la vía de administración de las células. De esta forma, la mayor parte de las cápsulas recuperadas por vía intraperitoneal estaban aisladas y pocas tenían fibrosis superficial causada por respuesta inmunológica. Por otra parte, las cápsulas aplicadas por la vía subcutánea constituían una estructura añadida que no presentaba ningún indicio de fibrosis por respuesta inmunológica. Estas estructuras, además, estaban llenas de capilares, debido a la capacidad de la hormona EPO para producir el crecimiento de los vasos sanguíneos.
A la vista de estos resultados positivos iniciales, nos planteamos una nueva pregunta: ¿durante cuánto tiempo las células emitirían EPO con una sola administración de cápsulas y sin utilizar medicamentos que inhiban la respuesta inmunológica? Para responder a esta pregunta volvimos a utilizar los ratones Balb/c y los resultados fueron muy significativos. De hecho, las células subcutáneas secrificaron el EPO durante 210 días. Y esa duración es la más larga que se ha conseguido jamás por esa vía. Una de las explicaciones que nos da la propia hormona EPO para obtener resultados positivos con diferentes tipos de ratón y diferentes vías de administración. De hecho, la hormona EPO tiene la capacidad de promover los vasos sanguíneos y desempeña diversas funciones en la respuesta inmunológica.
En resumen, podemos afirmar, por tanto, que la encapsulación de las células que segregan esta hormona es una alternativa tecnológica adecuada para la administración crónica del EPO. Nuestros próximos objetivos serán alargar el tratamiento y ajustar la concentración de EPO y por tanto el hematocrito a los niveles fisiológicos.
Si quieres saber másOrive, G. y otros 'Long-term expression of erythropoitein from myoblasts immobilized in biocompatible and neovascularized microcapsules' Molecular therapy Aprobado para publicación Schneider, B.L. y otros 'prevention of the initial host inmuno-inflammatory response determines the long-term survival of encapsulated myoblasts genetically engineered for erythropoietin delivery' Molecular therapy 7: 506-514. (2003). |