Ingeniería de tejidos: creando nuevo hueso
Los cirujanos ortopedistas se han convertido en expertos en coser e inmovilizar las fracturas matándolas. En las últimas décadas también han aprendido a introducir fragmentos óseos de otro lugar para reparar los principales daños. Sin embargo, algunas fracturas no admiten vacunas o no hay huesos adecuados para las vacunas. Por lo tanto, en EE.UU. y Europa se están investigando nuevas vías para sustituir el hueso roto: vacunaciones de biomateriales con señales moleculares, células madre de médula ósea y terapia génica. Estas son las líneas de investigación punteras en ingeniería textil.
Andamios moleculares: matrices
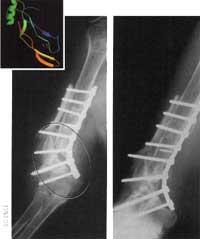
En una de las líneas de investigación se pretende utilizar las matrices artificiales como andamios para que los huesos se formen por sí mismos. La mayoría de las investigaciones se encuentran en fase experimental, pero ya existe un producto pendiente de autorización por parte de las administraciones públicas. Se trata de una matriz de colágeno, que contiene una proteína natural que genera la señal que manda a determinadas células del hueso empezar a regenerarse.
Durante muchos años, los cirujanos han utilizado soportes de colágeno e hidroxiapatita para atar las partes fracturadas y que el propio cuerpo reparara la herida. La técnica era adecuada, sobre todo en fracturas menores.
Ahora, sin embargo, los investigadores trabajan en la Universidad Rice de Houston y en la clínica Mayo de Rochester, en Minesota, en torno a un pionero del polímero de inyectar en el lugar a formar. El precursor se polimeriza inmediatamente después de entrar en la fractura, convirtiéndose en una matriz porosa que sirve de soporte a las nuevas células óseas. A medida que se forma el nuevo hueso, la matriz se deshace y se convierte en un metabolito natural que expulsará los cuerpos por su cuenta. En las pruebas realizadas con animales, se ha comprobado que estos polímeros proporcionan al hueso una resistencia mecánica, además de un crecimiento, y son totalmente biocompatibles. Además, los resultados son aún mejores si se coloca un nuevo soporte de apoyo a la matriz.
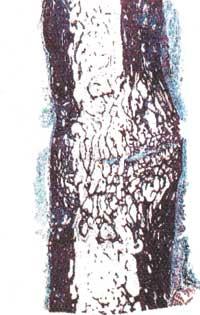
Pero el hueso no lo hace la propia matriz, sino unas proteínas mezcladas, llamadas proteínas morfométricas de los huesos (BMP). En la década de los 70 se aisló por primera vez una proteína de este grupo, pero hasta 1989 no consiguieron clonar (concretamente la proteína BMP-7) y en la década de los 90 se empezó a utilizar este grupo de proteínas para la reparación ósea. En 1992 se realiza el primer intento con humanos en una fractura ósea que no se formó durante 9 meses. El resultado fue muy bueno, igual o mejor que los que anteriormente obtuvieron introduciendo huesos sanos de los pacientes.
Pero todas las grandes esperanzas tienen su sangría, y este método también tiene limitaciones. Según algunos investigadores, en procesos naturales, para iniciar la reparación ósea bastan unos pocos nanogramos BMP por gramo de matriz ósea. Sin embargo, cuando se desea iniciar esta reparación de forma artificial, se necesitan microgramos por gramo de matriz artificial (seis veces más, aproximadamente). No se han detectado problemas de salud, pero sí encarecerían mucho el tratamiento.
Terapia génica
Otra opción es hacer llegar a la fractura el gen que provocará la formación del hueso mediante terapia génica.
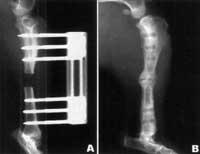
En las pruebas iniciales se utilizó adenovirus para llevar a la médula ósea el gen que originaría el BMP-2. Más tarde, las células transformadas crecían en matriz ósea desmineralizada y fueron introducidas en huesos rotos intencionadamente. Se formó bien el hueso dañado. En un intento similar con los perros, se utilizó el plasmido (parte circular del ADN) para hacer llegar el gen al hueso fracturado. El plásmido se metió en una matriz de polímeros y se introdujo en un agujero del hueso de un perro. Las células del entorno asimilaron el plásmido y lo expresaron durante unas seis semanas. El hueso se formó inmediatamente.
Ahora se están preparando pruebas con humanos.
Fuente de nuevas células
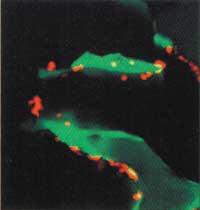
Sin embargo, algunos investigadores tienen un quebradero de cabeza: la escasez de células madre en el lugar roto en las dos técnicas anteriores puede ser un problema. A pesar de que las moléculas de señal inyectadas llegan a las células madre del lugar a reparar y consiguen separarlas, puede suceder que no haya células madre suficientes para curar grandes heridas. Por lo tanto, varios grupos intentan sustituir las células madre naturales por otras cultivadas en el laboratorio.
A diferencia de las células madre embrionarias, las células madre de la médula ósea, también llamadas células madre mesenquimales (MSC), no son capaces de transformarse en cualquier célula. Se convertirán en huesos, cartílagos y tendones o crines, así como en células nerviosas del corazón, músculo y columna. Aunque las células madre se producen a lo largo de toda la vida animal, parece que la cantidad disminuye con la edad. Y eso no es lo mejor para quien ha perdido grandes trozos de hueso.
Los estudios realizados en animales han puesto de manifiesto que los tratamientos con BMP presentan problemas para rellenar y completar huecos óseos mayores de 25 centímetros, ya que no son suficientes células madre. En estos casos, los BMP comienzan a ‘coger’ las células madre por el borde del hueso sano y crean el nuevo hueso hacia el centro del agujero, pero en el núcleo de la matriz no crece ningún hueso. El problema es el mismo si se coge y se inyecta hueso sano, si no hay suficiente células madre.
Por lo tanto, las células madre han empezado a introducirse en el área de reparación directa del ‘CEO of Osiris Therapeutics’ de Baltimore. Hacia 1990 las células madre de la médula ósea se depositaron en un sustrato cerámico poroso basado en el calcio y lograron formar fracturas de 8 milímetros. Más adelante trabajaron con animales más grandes y hoy en día quieren probar con seres humanos. Hasta el momento han conseguido buenos resultados con ratones, conejos y perros. Otros centros de investigación obtienen resultados similares.
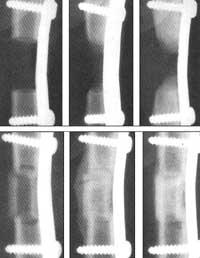
El problema de esta técnica es el tiempo y, por tanto, el dinero. Por el momento, al paciente se le deben extraer células madre, criar en el laboratorio e incorporarse al mismo paciente, lo que requiere tiempo. Por eso, los de Osiris están experimentando con la esperanza de que tomen de un animal y entren en otro. De hecho, las células madre de la médula ósea no tienen los marcadores que identifican las células T en las rechazos de las vacunas. Dicen que han conseguido que las células de los ratones y los perros se integren entre sí y que, además de no producir rechazo, los huesos han crecido normalmente.





