Accident de décompression et de surpression

Jusqu'à présent, nous avons travaillé la science à travers les essais, c'est-à-dire l'expérience, mais il peut parfois être très préjudiciable que les essais soient effectués sans savoir ce que dit la science. C'est pourquoi, aujourd'hui, nous apportons brièvement dans notre section les causes de l'accident de la décompression et de la surpression, si connus des plongeurs.
Étant au niveau de la mer, nous supportons une atmosphère de pression. En déplaçant 10 mètres vers le fond de la mer nous serons sous 2 atmosphères, 20 mètres sous 3 atmosphères, etc. D'autre part, la concentration de gaz solubles dans une solution coïncide avec une augmentation de pression. Ainsi, par exemple, dans le cas de 3 atmosphères, la concentration de gaz que notre corps peut accepter sera environ trois fois plus élevée qu'en terre, selon la loi de Boyle et Mariotte.
Mais où commencent les problèmes ?
Lorsque l'immersion est terminée et que nous montons, la pression extérieure diminue. Cependant, la pression de l'air que nous avons dans notre corps ne diminue pas aussi rapidement. Par conséquent, l'air va essayer de le sortir du corps en formant des bulles. Si les bulles se forment dans les poumons, ceux-ci peuvent exploser par surpression. Des bulles peuvent également se former dans les vaisseaux sanguins, entravant la circulation sanguine et provoquant un accident de décompression. Pour éviter que l'un et l'autre ne se produise, nous devons remplacer notre air intérieur par une autre pression inférieure pendant que nous montons et donner du temps au corps pour que ce processus se déroule dans tous les poumons et les vaisseaux sanguins.
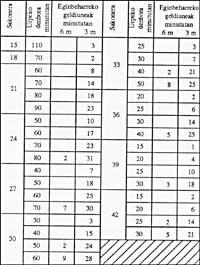
Le tableau de décompression suivant est joint au cas où il peut aider.