Accident de descompressió i de sobrepressió

Fins ara hem treballat la ciència a través dels assajos, és a dir, experimentant, però a vegades pot resultar molt perjudicial que els assajos es realitzin sense saber què diu la ciència. Per això, avui portem a la nostra secció breument les causes de l'accident de descompressió i de sobrepressió, tan coneguts entre els bussejadors.
Estant a nivell de la mar, suportem una atmosfera de pressió. Ficant 10 metres cap al fons de la mar estarem baix 2 atmosferes, 20 metres sota 3 atmosferes, etc. D'altra banda, la concentració de gasos solubles en una dissolució coincideix amb l'augment de pressió. Així, per exemple, en el cas de 3 atmosferes, la concentració de gasos que el nostre cos pot acceptar serà aproximadament tres vegades major que en terra, segons estableix la Llei de Boyle i Mariotte.
Però, on comencen els problemes?
Quan donem per acabada la inmertización i anem ascendint, la pressió exterior va disminuint. No obstant això, la pressió de l'aire que tenim dins del nostre cos no disminueix tan ràpidament. Per tant, l'aire intentarà treure'l del cos formant bombolles. Si les bombolles es formen en els pulmons, aquests poden explotar per sobrepressió. També es poden formar bombolles en els vasos sanguinis, dificultant la circulació de la sang i provocant un accident de descompressió. Per a evitar que ocorri l'un i l'altre, hem de substituir el nostre aire interior per un altre de menor pressió mentre pugem i donar temps al cos perquè aquest procés es dugui a terme en tots els pulmons i vasos sanguinis.
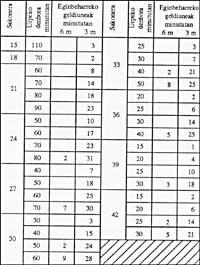
S'adjunta la següent taula de descompressió que per si de cas pot ajudar.