CRISPR, técnica de edición del genoma: beneficios e inquietudes
“Yo todavía no lo uso, pero seguramente empezaré este año”, afirma el genético de la UPV José Antonio Rodríguez Pérez. Rodríguez quiere utilizar la técnica CRISPR para investigar una mutación relacionada con la leucemia. Para estudiar el efecto de esta mutación necesita células con mutación. “Hasta ahora la única opción era tomar células de los pacientes, pero eso es muy difícil. Es mucho más fácil meter esa mutación en las células que tenemos en el laboratorio”. Puede hacerlo con CRISPR.

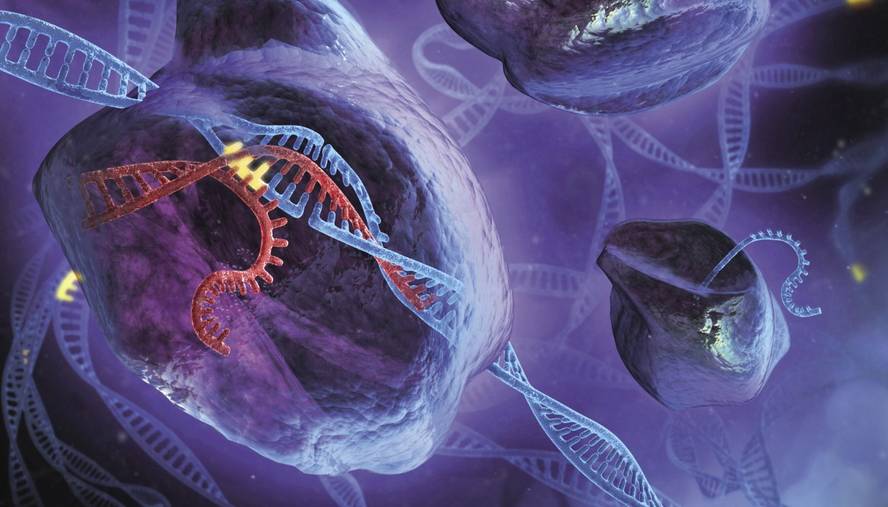
La técnica CRISPR sirve para editar el ADN con gran precisión. Se pueden retirar los fragmentos de ADN donde se desee y sustituirlos por otros nuevos. Eso no es nuevo, ya había otras técnicas para hacerlo. “Lo más importante es que ha simplificado y abaratado mucho las cosas”, ha subrayado Rodríguez.
Otros instrumentos muy similares al CRISPR, como TALEN y ZFN. “Estos aparatos hacen lo mismo que el CRISPR, pero para utilizarlos tienes que diseñar y montar una proteína que es muy cara. Con el CRISPR debes diseñar una molécula de ARN que es muy barata. Supongamos que se necesitan 100 euros para ello, pues con las técnicas anteriores se necesitarían miles de euros”.
Democratización
Facilitar tanto las cosas abre muchas posibilidades. “Puedes probar cosas diferentes. Muchos proyectos se basan en pruebas y si tienes que invertir 5.000 euros, pues igual no vas a empezar, pero si son 200 euros puedes probarlo”, explica Rodríguez. Además, “ha democratizado estos experimentos, que podrán ser realizados por mucha gente que antes no podía. Antes no podíamos hacer este tipo de proyectos pequeños laboratorios, pero ahora sí con CRISPR. Por eso se ha extendido tan rápido y de esta manera exponencial”.
En 2012 se publicó Sciencen Jennifer Doudna y Emmanuelle Charpentier que el complejo enzimático CRISPR-Cas9 de bacterias podía ser utilizado como herramienta de edición genética. Este complejo está formado por una guía RNA y la enzima Cas9. La enzima corta el ADN en el lugar que le da la guía RNA. De esta forma se puede editar el genoma donde se desee, sintetizando el RNA complementario al lugar.
Ofrece enormes posibilidades de investigación básica y sus aplicaciones pueden ser múltiples. La terapia génica es una de las más esperanzadoras. “Se ha dado un paso gigante”, afirma la genética de la UPV Ana Aguirre Escobal. “Hasta ahora, con la terapia génica, además de ser muy cara, se obtenían muy pocos buenos resultados, porque la técnica no era buena. Ahora, sin embargo, se espera que estos resultados mejoren mucho”.
Rodríguez está de acuerdo: “En algunas enfermedades puede ser muy importante. En muchas enfermedades monogénicas está bien identificado el gen y los defectos y cómo corregirlos. Pero hasta ahora no se podía corregir un gen. Si un gen estaba mal, se introducía otra copia directa de ese gen”. Esta copia se introducía a través de un vector y se insertaría aleatoriamente en el genoma, y había que esperar que ese gen cumpliera su función. Ahora se puede introducir la copia correcta en el lugar que corresponde a ese gen, eliminando la anterior. “Ahora los genes se pueden corregir de verdad”, matiza Rodríguez.
Trabajando el camino hacia la terapia
En 2014 investigadores del MIT utilizaron por primera vez la técnica CRISPR para curar una enfermedad en animales adultos. Fue utilizada en el ratón para corregir la mutación que produce la enfermedad hepática llamada tirosinemia en humanos. Consiguieron curar el mal, pero al mismo tiempo, este trabajo demostró que la técnica tenía también algunos problemas a resolver.
Por un lado, la técnica utilizada para introducir la enzima Cas9 y la guía ARN en las células del hígado, la inyección a alta presión, no es adecuada para ser aplicadas en humanos. Y por otro lado, sólo en una de las 250 células consiguieron corregir la mutación. En este caso bastó para curar la enfermedad, pero es muy probable que no sea en muchas otras enfermedades.
Por otro lado, “el CRISPR todavía tiene efectos inespecíficos —añade Rodríguez—, a veces se puede asociar el ARN en otra parte del genoma. La técnica sigue siendo optimizada, pero existe la posibilidad de mejorarla. Por ejemplo, hasta ahora se ha utilizado la enzima Cas-9, pero otras están probando y pueden ser más específicas”.
El equipo del MIT que consiguió curar la tirosinemia en los ratones ya ha conseguido mejorar la técnica. En febrero se publicó una forma más segura y eficaz de llegar a las células del hígado de los ratones. La guía RNA y el fragmento directo de ADN fueron introducidos por un virus y un RNA mensajero que codifica la enzima Cas9 mediante nanopartículas. Así, en una de cada 16 células se consiguió la corrección. Y apenas detectaron efectos no específicos.
Hay más ejemplos, por ejemplo, que en diciembre tres grupos de investigación demostraron en artículos publicados simultáneamente en Science que en el ratón lograron mejorar la distrofia muscular Duchenne. La cuestión va rápido, pero Rodríguez cree que todavía se va a necesitar tiempo para aplicarla en humanos: “No creo que estemos en condiciones de hacerlo el año que viene, pero dentro de unos años yo creo que será posible realizar cambios con gran precisión en los seres humanos. Luego tendremos que comprobar si se permite o cómo se controla”.
Preocupaciones sobre la mesa
De hecho, a medida que la capacidad de la técnica ha ido quedando clara su cuantía, y a la vista de la rapidez con la que se está extendiendo, también han aumentado las preocupaciones éticas. “La sencillez es la parte positiva de esta técnica, pero también la negativa, ya que “jugar” con esta herramienta es fácil”, ha señalado Rodríguez. “Yo veo sobre todo aspectos positivos. Y es que los riesgos de la técnica están ahí, pero los de otras técnicas están como hace tiempo”.
Otros, por su parte, otorgan mayor importancia a los riesgos. En marzo de 2015, un grupo de expertos se opuso al CRISPR y al resto de técnicas para la transformación de embriones humanos en un artículo publicado en la revista Nature. Estos expertos creían que esto podía ocurrir en breve. Y un mes después, investigadores de la Universidad de Sun Yats en China publicaron la transformación de embriones humanos mediante la técnica CRISPR. Utilizaron embriones que no podían desarrollarse, pero el experimento acabó con las preocupaciones ya existentes.
Ante esta situación, las academias de ciencia y medicina estadounidenses, la Royal Society de Londres y la Academia China de la Ciencia organizaron una reunión para hablar de estas inquietudes. En diciembre se reunieron en Washington 500 expertos de todo el mundo y llegaron a un acuerdo provisional: no prohibir la edición del genoma humano de investigación, pero sí la utilización de embriones modificados para los embarazos.

“Una buena cosa de la ciencia es que todo es muy público. Se habla y se escucha y se toman decisiones en función de lo que está pasando”, afirma Aguirre. Aguirre es ex presidente del Comité de Ética de la Investigación en Asuntos Biológicos y Organismos Modificados Genéticamente de la UPV/EHU, y el debate que se ha generado ahora con motivo del CRISPR no ha sido nuevo. “Recuerdo que en los años 70, cuando aparecieron las primeras técnicas de ingeniería genética, los expertos se reunieron en Asilomar (California). Decidieron imponer una moratoria. Hubo que esperar unos años para comprobar que las técnicas eran seguras. Ahora ha pasado algo parecido, han hablado y acordado: ‘antes de empezar a hablar de las aplicaciones, hagamos cocinas en el laboratorio para mejorar, optimizar y hacer lo más seguro posible’.
El debate es antiguo. “Cosas que hasta ahora se veían lejanas o muy teóricas, ahora se han visto más cercanas y factibles, lo que ha resucitado un viejo debate semi-muerto en los últimos años”. Además, Aguirre considera que hay otro factor que ha hecho aumentar la preocupación: “algunos han advertido que muchas leyes que regulan y regulan organismos genéticamente modificados, tal y como están redactadas, excluyen la técnica CRISPR”. De hecho, en estas leyes se habla de la recombinación y del ADN extraño, pero en la técnica del CRISPR no lo hay. “No tengo ninguna duda de que estas leyes se adaptarán para regular la nueva técnica, pero es cierto que en este momento no se ha producido”.
Sin embargo, su regulación o regulación varía mucho de país a país. En países como Japón, China e India existen normas que prohíben realizar transformaciones genéticas en embriones humanos, pero no tienen efectos legales. La regulación en Rusia y Argentina es muy ambigua.En Estados Unidos está prohibida la financiación con dinero público, pero la ley no prohíbe la aplicación clínica. Y en Europa, en general, está prohibida en la clínica y limitada a la investigación. Recientemente en el Reino Unido se ha autorizado a los investigadores del Instituto Francis Crick a utilizar la técnica CRISPR para investigar el desarrollo de embriones humanos.
Miedos y expectativas
Las preocupaciones y miedos que ha generado el CRISPR son de siempre. “Básicamente, en lo que se refiere a los animales y las plantas hay que analizar bien si estas transformaciones son seguras o no, si los organismos que se generan pueden suponer un riesgo para el ser humano o los ecosistemas”, ha explicado Aguirre. “En cuanto al ser humano, creo que a las cuestiones de seguridad se añade el concepto de individuo. Cuando hablamos de cambiar la secuencia de ADN nos ponemos nerviosos porque nos parece que de alguna manera va a influir en nuestra individualidad”.
Sin embargo, Aguirre considera que en la práctica el debate pasa a otro plano: “si tenemos cerca una persona con enfermedad genética y hay una oportunidad de curarla, entonces es lo que nos importa. Yo creo que cuando se ve que tiene aplicaciones reales, que pueden mejorar la vida de las personas, que la sociedad verá mejor estas técnicas”.
Es lo que ha sucedido con muchos avances científicos. “Ocurrió con fecundación asistida. Al principio era despreciable, pero poco a poco la sociedad lo ha demandado, y los niños nacidos con la fecundación ya asistida ya no se ven como demonios, como se veían los iniciales”.
Sin embargo, la transformación genética puede tener aplicaciones más discutibles que la curación de enfermedades, como la transformación de embriones para mejorar ciertas características. Sin embargo, Aguirre no ve por el momento demasiados motivos para preocuparse, “Aunque se ve más cerca porque puede permitir la técnica, creo que todavía es una utopía, un miedo teórico”.
Además, destaca que el control es riguroso: “Cualquier técnica de cambio genómico, como la terapia génica, requiere pasar por diferentes comités. En el Estado español, por ejemplo, hay una comisión nacional muy exigente y hay que obtener su autorización. Pero además, si se quieren realizar pruebas en un hospital, hay que pasar también por los comités éticos de ese hospital y de la comunidad autónoma. Ya existe una estructura y, en todo caso, ese control se endurecerá a partir de ahora, ya que no creo que la mejora genética tenga soporte social. Por lo tanto, no creo que haya motivos de preocupación”.
Riesgo de transformación de ecosistemas
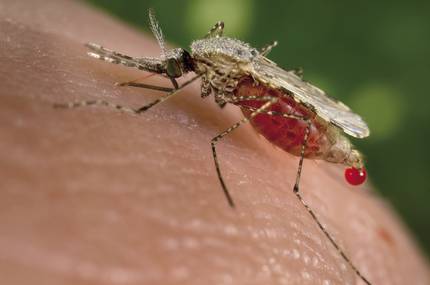
Otra de las preocupaciones es el efecto que los seres vivos modificados genéticamente pueden tener sobre los ecosistemas. Y esas inquietudes fueron suscitadas por otro trabajo publicado en noviembre. Científicos de la Universidad de California crearon mosquitos transgénicos resistentes al parásito responsable de la malaria. En este caso, además, gracias a la técnica CRISPR, lograron que el 99% de los descendientes de mosquitos modificados heredan el gen del anticuerpo y el gen fuera activo en esos mosquitos. Así, estimaron que 10 generaciones serían suficientes para expandirse en una población.
La capacidad de incidencia sobre la población ha generado una gran preocupación. Aguirre también confía en los estrictos controles que existen. “Otros mosquitos transgénicos contra la malaria, realizados mediante otra técnica, ya han sido liberados. Pero para ello tuvieron que pasar 10 años de controles. La obtención de este tipo de autorización requiere de numerosos y muy profundos estudios y evaluaciones que permitan conocer los riesgos y beneficios. Es cierto que en esos casos el riesgo cero no existe. En este caso, tras poner todos los informes sobre riesgos y beneficios sobre la mesa, y teniendo en cuenta el enorme nivel de malaria, los políticos decidieron liberar los mosquitos transgénicos. En definitiva, es una herramienta que pone la ciencia al alcance de la sociedad y que ésta debe decidir qué hacer con ella”.





