CRISPR, tècnica d'edició del genoma: beneficis i inquietuds
“Jo encara no ho uso, però segurament començaré enguany”, afirma el genètic de la UPV José Antonio Rodríguez Pérez. Rodríguez vol utilitzar la tècnica CRISPR per a investigar una mutació relacionada amb la leucèmia. Per a estudiar l'efecte d'aquesta mutació necessita cèl·lules amb mutació. “Fins ara l'única opció era prendre cèl·lules dels pacients, però això és molt difícil. És molt més fàcil ficar aquesta mutació en les cèl·lules que tenim en el laboratori”. Pot fer-ho amb CRISPR.

La tècnica CRISPR serveix per a editar l'ADN amb gran precisió. Es poden retirar els fragments d'ADN on es desitgi i substituir-los per altres nous. Això no és nou, ja hi havia altres tècniques per a fer-ho. “El més important és que ha simplificat i abaratit molt les coses”, ha subratllat Rodríguez.
Altres instruments molt similars al CRISPR, com TALEN i ZFN. “Aquests aparells fan el mateix que el CRISPR, però per a utilitzar-los has de dissenyar i muntar una proteïna que és molt cara. Amb el CRISPR has de dissenyar una molècula d'ARN que és molt barata. Suposem que es necessiten 100 euros per a això, perquè amb les tècniques anteriors es necessitarien milers d'euros”.
Democratització
Facilitar tant les coses obre moltes possibilitats. “Pots provar coses diferents. Molts projectes es basen en proves i si has d'invertir 5.000 euros, perquè igual no començaràs, però si són 200 euros pots provar-ho”, explica Rodríguez. A més, “ha democratitzat aquests experiments, que podran ser realitzats per molta gent que abans no podia. Abans no podíem fer aquest tipus de projectes petits laboratoris, però ara sí amb CRISPR. Per això s'ha estès tan ràpid i d'aquesta manera exponencial”.
En 2012 es va publicar Sciencen Jennifer Doudna i Emmanuelle Charpentier que el complex enzimàtic CRISPR-Cas9 de bacteris podia ser utilitzat com a eina d'edició genètica. Aquest complex està format per una guia RNA i l'enzim Cas9. L'enzim curt l'ADN en el lloc que li dóna la guia RNA. D'aquesta forma es pot editar el genoma on es desitgi, sintetitzant l'RNA complementari al lloc.
Ofereix enormes possibilitats de recerca bàsica i les seves aplicacions poden ser múltiples. La teràpia gènica és una de les més esperançadores. “S'ha fet un pas gegant”, afirma la genètica de la UPV Ana Aguirre Escobal. “Fins ara, amb la teràpia gènica, a més de ser molt cara, s'obtenien molt pocs bons resultats, perquè la tècnica no era bona. Ara, no obstant això, s'espera que aquests resultats millorin molt”.
Rodríguez està d'acord: “En algunes malalties pot ser molt important. En moltes malalties monogénicas està ben identificat el gen i els defectes i com corregir-los. Però fins ara no es podia corregir un gen. Si un gen estava mal, s'introduïa una altra còpia directa d'aquest gen”. Aquesta còpia s'introduïa a través d'un vector i s'inseriria aleatòriament en el genoma, i calia esperar que aquest gen complís la seva funció. Ara es pot introduir la còpia correcta en el lloc que correspon a aquest gen, eliminant l'anterior. “Ara els gens es poden corregir de debò”, matisa Rodríguez.
Treballant el camí cap a la teràpia
En 2014 investigadors del MIT van utilitzar per primera vegada la tècnica CRISPR per a curar una malaltia en animals adults. Va ser utilitzada en el ratolí per a corregir la mutació que produeix la malaltia hepàtica anomenada tirosinemia en humans. Van aconseguir curar el malament, però al mateix temps, aquest treball va demostrar que la tècnica tenia també alguns problemes a resoldre.
D'una banda, la tècnica utilitzada per a introduir l'enzim Cas9 i la guia ARN en les cèl·lules del fetge, la injecció a alta pressió, no és adequada per a ser aplicades en humans. I d'altra banda, només en una de les 250 cèl·lules van aconseguir corregir la mutació. En aquest cas va bastar per a curar la malaltia, però és molt probable que no sigui en moltes altres malalties.
D'altra banda, “el CRISPR encara té efectes inespecífics —afegeix Rodríguez—, a vegades es pot associar l'ARN en una altra part del genoma. La tècnica continua sent optimitzada, però existeix la possibilitat de millorar-la. Per exemple, fins ara s'ha utilitzat l'enzim Cas-9, però unes altres estan provant i poden ser més específiques”.
L'equip del MIT que va aconseguir curar la tirosinemia en els ratolins ja ha aconseguit millorar la tècnica. Al febrer es va publicar una forma més segura i eficaç d'arribar a les cèl·lules del fetge dels ratolins. La guia RNA i el fragment directe d'ADN van ser introduïts per un virus i un RNA missatger que codifica l'enzim Cas9 mitjançant nanopartícules. Així, en una de cada 16 cèl·lules es va aconseguir la correcció. I a penes van detectar efectes no específics.
Hi ha més exemples, per exemple, que al desembre tres grups de recerca van demostrar en articles publicats simultàniament en Science que en el ratolí van aconseguir millorar la distròfia muscular Duchenne. La qüestió va ràpid, però Rodríguez creu que encara es necessitarà temps per a aplicar-la en humans: “No crec que estiguem en condicions de fer-ho l'any que ve, però d'aquí a uns anys jo crec que serà possible realitzar canvis amb gran precisió en els éssers humans. Després haurem de comprovar si es permet o com es controla”.
Preocupacions sobre la taula
De fet, a mesura que la capacitat de la tècnica ha anat quedant clara la seva quantia, i a la vista de la rapidesa amb la qual s'està estenent, també han augmentat les preocupacions ètiques. “La senzillesa és la part positiva d'aquesta tècnica, però també la negativa, ja que “jugar” amb aquesta eina és fàcil”, ha assenyalat Rodríguez. “Jo veig sobretot aspectes positius. I és que els riscos de la tècnica són aquí, però els d'altres tècniques estan com fa temps”.
Uns altres, per part seva, atorguen major importància als riscos. Al març de 2015, un grup d'experts es va oposar al CRISPR i a la resta de tècniques per a la transformació d'embrions humans en un article publicat en la revista Nature. Aquests experts creien que això podia ocórrer en breu. I un mes després, investigadors de la Universitat de Sun Yats a la Xina van publicar la transformació d'embrions humans mitjançant la tècnica CRISPR. Van utilitzar embrions que no podien desenvolupar-se, però l'experiment va acabar amb les preocupacions ja existents.
Davant aquesta situació, les acadèmies de ciència i medicina estatunidenques, la Royal Society de Londres i l'Acadèmia Xinesa de la Ciència van organitzar una reunió per a parlar d'aquestes inquietuds. Al desembre es van reunir a Washington 500 experts de tot el món i van arribar a un acord provisional: no prohibir l'edició del genoma humà de recerca, però sí la utilització d'embrions modificats per als embarassos.

“Una bona cosa de la ciència és que tot és molt públic. Es parla i s'escolta i es prenen decisions en funció del que està passant”, afirma Aguirre. Aguirre és ex president del Comitè d'Ètica de la Recerca en Assumptes Biològics i Organismes Modificats Genèticament de la UPV/EHU, i el debat que s'ha generat ara amb motiu del CRISPR no ha estat nou. “Record que en els anys 70, quan van aparèixer les primeres tècniques d'enginyeria genètica, els experts es van reunir en Asilomar (Califòrnia). Van decidir imposar una moratòria. Va caldre esperar uns anys per a comprovar que les tècniques eren segures. Ara ha passat una cosa semblant, han parlat i acordat: ‘abans de començar a parlar de les aplicacions, fem cuines en el laboratori per a millorar, optimitzar i fer el més segur possible’.
El debat és antic. “Coses que fins ara es veien llunyanes o molt teòriques, ara s'han vist més pròximes i factibles, la qual cosa ha ressuscitat un vell debat semi-mort en els últims anys”. A més, Aguirre considera que hi ha un altre factor que ha fet augmentar la preocupació: “alguns han advertit que moltes lleis que regulen i regulen organismes genèticament modificats, tal com estan redactades, exclouen la tècnica CRISPR”. De fet, en aquestes lleis es parla de la recombinació i de l'ADN estrany, però en la tècnica del CRISPR no n'hi ha. “No tinc cap dubte que aquestes lleis s'adaptaran per a regular la nova tècnica, però és cert que en aquest moment no s'ha produït”.
No obstant això, la seva regulació o regulació varia molt de país a país. En països com el Japó, la Xina i l'Índia existeixen normes que prohibeixen realitzar transformacions genètiques en embrions humans, però no tenen efectes legals. La regulació a Rússia i l'Argentina és molt ambigua.Als Estats Units està prohibida el finançament amb diners públics, però la llei no prohibeix l'aplicació clínica. I a Europa, en general, està prohibida en la clínica i limitada a la recerca. Recentment al Regne Unit s'ha autoritzat els investigadors de l'Institut Francis Crick a utilitzar la tècnica CRISPR per a investigar el desenvolupament d'embrions humans.
Pors i expectatives
Les preocupacions i pors que ha generat el CRISPR són de sempre. “Bàsicament, pel que fa als animals i les plantes cal analitzar bé si aquestes transformacions són segures o no, si els organismes que es generen poden suposar un risc per a l'ésser humà o els ecosistemes”, ha explicat Aguirre. “Quant a l'ésser humà, crec que a les qüestions de seguretat s'afegeix el concepte d'individu. Quan parlem de canviar la seqüència d'ADN ens posem nerviosos perquè ens sembla que d'alguna manera influirà en la nostra individualitat”.
No obstant això, Aguirre considera que en la pràctica el debat passa a un altre pla: “si tenim a prop una persona amb malaltia genètica i hi ha una oportunitat de curar-la, llavors és el que ens importa. Jo crec que quan es veu que té aplicacions reals, que poden millorar la vida de les persones, que la societat veurà millor aquestes tècniques”.
És el que ha succeït amb molts avanços científics. “Va ocórrer amb fecundació assistida. Al principi era menyspreable, però a poc a poc la societat l'ha demandat, i els nens nascuts amb la fecundació ja assistida ja no es veuen com a dimonis, com es veien els inicials”.
No obstant això, la transformació genètica pot tenir aplicacions més discutibles que la curació de malalties, com la transformació d'embrions per a millorar certes característiques. No obstant això, Aguirre no veu de moment massa motius per a preocupar-se, “Encara que es veu més a prop perquè pot permetre la tècnica, crec que encara és una utopia, una por teòrica”.
A més, destaca que el control és rigorós: “Qualsevol tècnica de canvi genómico, com la teràpia gènica, requereix passar per diferents comitès. En l'Estat espanyol, per exemple, hi ha una comissió nacional molt exigent i cal obtenir la seva autorització. Però a més, si es volen realitzar proves en un hospital, cal passar també pels comitès ètics d'aquest hospital i de la comunitat autònoma. Ja existeix una estructura i, en tot cas, aquest control s'endurirà a partir d'ara, ja que no crec que la millora genètica tingui suport social. Per tant, no crec que hi hagi motius de preocupació”.
Risc de transformació d'ecosistemes
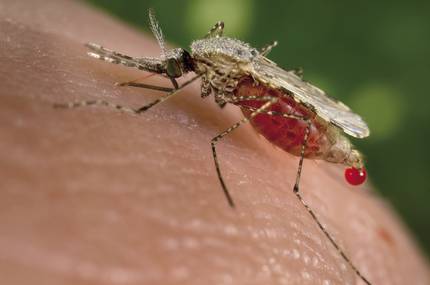
Una altra de les preocupacions és l'efecte que els éssers vius modificats genèticament poden tenir sobre els ecosistemes. I aquestes inquietuds van ser suscitades per un altre treball publicat al novembre. Científics de la Universitat de Califòrnia van crear mosquits transgènics resistents al paràsit responsable de la malària. En aquest cas, a més, gràcies a la tècnica CRISPR, van aconseguir que el 99% dels descendents de mosquits modificats hereten el gen de l'anticòs i el gen fos actiu en aquests mosquits. Així, van estimar que 10 generacions serien suficients per a expandir-se en una població.
La capacitat d'incidència sobre la població ha generat una gran preocupació. Aguirre també confia en els estrictes controls que existeixen. “Altres mosquits transgènics contra la malària, realitzats mitjançant una altra tècnica, ja han estat alliberats. Però per a això van haver de passar 10 anys de controls. L'obtenció d'aquesta mena d'autorització requereix de nombrosos i molt profunds estudis i avaluacions que permetin conèixer els riscos i beneficis. És cert que en aquests casos el risc zero no existeix. En aquest cas, després de posar tots els informes sobre riscos i beneficis sobre la taula, i tenint en compte l'enorme nivell de malària, els polítics van decidir alliberar els mosquits transgènics. En definitiva, és una eina que posa la ciència a l'abast de la societat i que aquesta ha de decidir què fer amb ella”.





