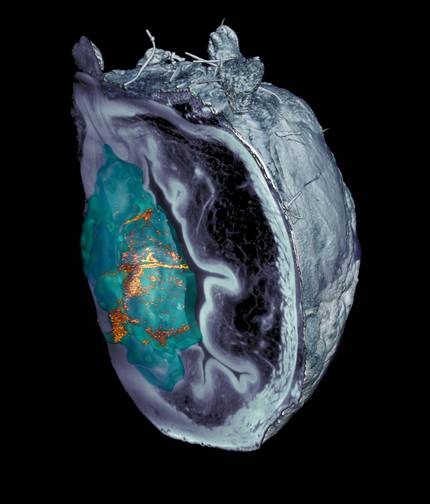
Han conseguido reducir en un 90% los tumores de vejiga con nanorrobots
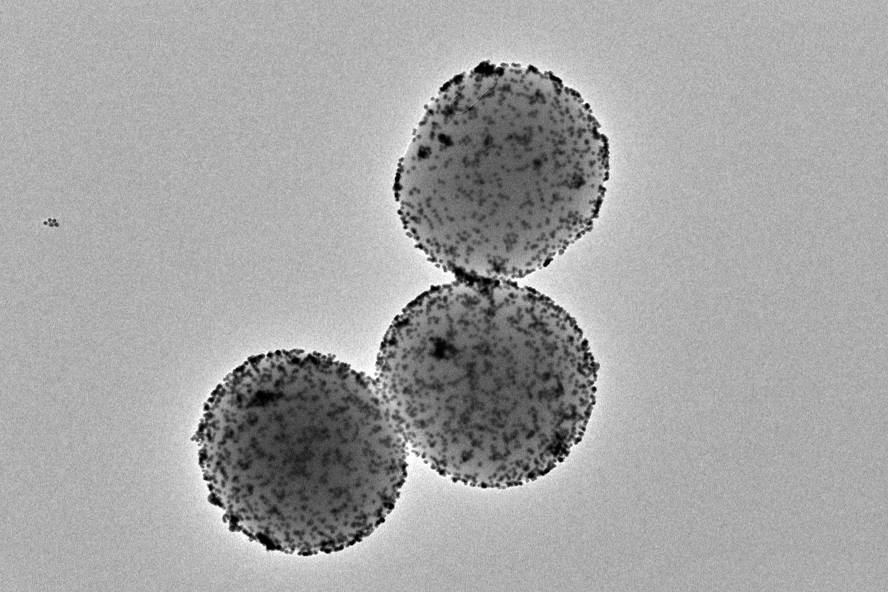
Han conseguido reducir en un 90% los tumores de vejiga en el ratón, con una sola dosis de nanorrobots. Estas pequeñas nanomaquinas se propulsan con agua de orina, llegan al tumor y son atacadas con un radioisótopo superficial. Este trabajo, liderado por el Instituto Catalán de Bioingeniería y CIC biomaGUNE, ha sido publicado en la revista Nature Nanotechnology.
El cáncer de vejiga es uno de los tumores con mayor tasa de incidencia del mundo y el cuarto tumor más frecuente en los hombres. Aunque su mortalidad no es alta, es una de las más difíciles de curar y casi la mitad de los tumores reaparecen a los cinco años. En los tratamientos actuales, los fármacos se administran directamente en el interior de la vejiga, pero a pesar de las buenas tasas de supervivencia, la eficacia terapéutica es baja.
Así, la utilización de nanopartículas es una opción esperanzadora, ya que son capaces de transmitir directamente el agente terapéutico al tumor. Destacan los nanorrobots, nanopartículas capaces de moverse dentro del cuerpo.
Los nanorobots utilizados en este estudio tienen una esfera porosa de sílice con varios componentes de función específica en superficie. Una de ellas es la enzima ureasa, una proteína que reacciona con la urea presente en la orina y que confiere a la nanopartícula la capacidad de propulsarla. Otro componente clave es el yodo radiactivo, un radioisótopo utilizado frecuentemente para el tratamiento localizado de tumores.
En el estudio con los ratones se observa que con una sola dosis el volumen del tumor disminuye un 90%. Es mucho más eficiente teniendo en cuenta que es frecuente que pacientes con este tipo de tumores tengan que acudir al hospital de 6 a 14 veces. Ahora se está estudiando la reaparición de estos tumores tras el tratamiento.
Hasta dentro del tumor
En estudios anteriores se ha observado que la capacidad de autopropulsión de los nanorrobots permite llegar a todas las paredes de la vejiga. Este nuevo trabajo va más allá al comprobar que las nanopartículas se mueven en la vejiga y se acumulan específicamente en el tumor. Además, han visto que, además de llegar al tumor, penetran en el interior, lo que aumenta la influencia del radiofármaco.
El reto fue aclarar por qué los nanorrobots son capaces de penetrar en el interior del tumor. Los nanorrobots carecen de anticuerpos específicos para reconocer el tumor y, generalmente, el tejido tumoral es más rígido que el tejido sano.
Se ha observado que estos nanorrobots tienen la capacidad de descomponer la matriz extracelular del tumor, ya que elevan localmente el pH mediante una reacción química de autopropulsión. Así, los investigadores han llegado a la conclusión de que los nanorrobots chocan con el urotelio como si de una pared se tratara, pero en el tumor, al ser más inflamado, entran y se acumulan en él.
Además, la administración localizada de nanorrobots que transportan el radioisótopo reduce el riesgo de efectos adversos y la elevada acumulación en el tejido tumoral aumenta el efecto terapéutico.
Los investigadores han explicado que este trabajo ha abierto las puertas a la utilización de otros radioisótopos con mayor capacidad de incidencia terapéutica.