Amadeo Avogadro
Elhuyar Fundazioa
Físico italiano nado en Turín, Piamonte, o 9 de xuño de 1776.
Estudou dereito e en 1800 empezou a estudar matemáticas e física. Como el traballou en profundidade as ciencias, exercendo a docencia. En 1809 foi nomeado profesor de matemáticas e física no colexio real de Vercelli e a partir de 1820 profesor de física superior na Universidade de Turín.
Segundo o achado de Gai-Lussac, a medida que a temperatura aumentaba, todos os gases distribuíanse na mesma proporción, e Avogadro, estudándoo, tivo una idea. Considera que todos os gases debían ter o mesmo número de partículas por unidade de volume a unha temperatura determinada. Esta idea foi trasladada en 1811 e comentou con moito coidado que as partículas mencionadas non tiñan en que consistían os átomos individuais. Tamén podían existir combinacións atómicas (as que hoxe chamamos moléculas).
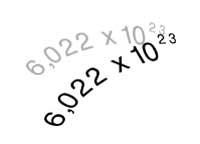
A partir de aí explicou con facilidade a lei de combinación de volumes de Gai-Lussac. XIX. A principios de século Ritter electrolizó a auga recollendo o osíxeno e o hidróxeno separados. Puido comprobar que o volume de osíxeno era a metade que o do hidróxeno. Avogadro demostrou entón que, aplicando a súa hipótese, a molécula de auga tiña dous átomos de hidróxeno e un átomo de osíxeno. Si o peso total do osíxeno recolleito era oito veces maior que o do hidróxeno, o átomo de osíxeno era dezaseis veces máis pesado (e non, segundo Dalton, oito veces máis pesado).
Con todo, as ideas de Avogadro non foron tomadas en consideración nas próximas décadas. Dalton abandonounas e o químico máis famoso da época, Berzelius, chegou até o cancro. Como consecuencia diso, os químicos tiveron grandes mesturas, inseparables átomos, moléculas, pesos atómicos e pesos moleculares.
Estanislao Cannizzaro foi o primeiro que tivo en conta a Avogadro, dous anos despois da súa morte, e foi entón cando logrou a reputación que a ciencia turista negoulle na súa vida.
Na actualidade é coñecido como Avogadro, porque o número que leva o seu nome serve paira calcular cantos átomos (ou moléculas) ten o peso atómico expresado en gramos. O óxido de carbono (IV), por exemplo, ten un peso molecular 44 e en 44 gramos deste gas haberá tantas moléculas como o número de Avogadro, é dicir, 6,022x1023 moléculas (602.600 moléculas de trilión).
Tamén se utiliza en Química paira definir o mol. Un mol de sustancia é a cantidade que contén 6,022x1023 unidades de devandita sustancia.
Avogadro Quaregna e Conde de Ceretto durante a súa vida, faleceu en Turín o 9 de xullo de 1856.





